题目内容
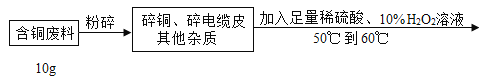
【题目】我国制碱工业的科技工作者将制碱与制氨结合起来形成的联合制碱法,为氮肥工业技术的发展做出了杰出的贡献.其工业流程示意图如下:
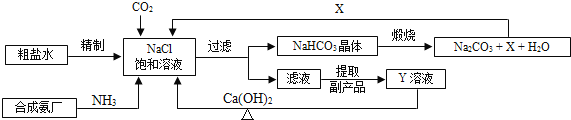
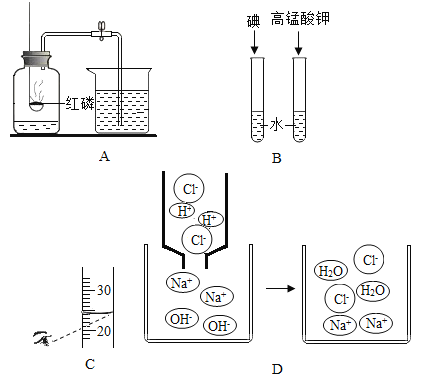
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序(写化学式)为 _________、_________、________、盐酸。
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则反应②的反应类型为 ________。
(3)写出煅烧碳酸氢钠晶体的化学方程式____________。
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,Y的化学式为_________,写出Y的一种农业上的用途__________.
(5)实验中要向食盐水中先通入氨气再通入气体CO2,你认为原因是___________.(填写字母)
A氨气的密度比气体CO2小
B氨气极易溶于水,使溶液呈碱性后吸收更多的气体CO2
(6)工业的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是______________。
(7)循环利用的物质是H2O,__________和___________.
【答案】NaOH BaCl2 Na2CO3 复分解反应 2NaHCO3![]() CO2↑+H2O+ Na2CO3 NH4Cl 氮肥或化肥 B 碳酸氢钠的溶解度比氯化铵的溶解度小 氨气 二氧化碳
CO2↑+H2O+ Na2CO3 NH4Cl 氮肥或化肥 B 碳酸氢钠的溶解度比氯化铵的溶解度小 氨气 二氧化碳
【解析】
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序为 NaOH、BaCl2、Na2CO3、盐酸。先加入过滤氢氧化钠与镁离子反应产生氢氧化镁沉淀,然后加入过量的氯化钡与硫酸根离子反应产生硫酸钡沉淀,再加入过量的碳酸钠与钙离子和过量氯化钡反应产生碳酸钙沉淀和碳酸钡沉淀,过滤,最后加入稀盐酸与过量的氢氧化钠反应产生氯化钠溶液,与过量的碳酸钠反应也产生氯化钠溶液;
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则反应②符合“量交换、不变价”属于复分解反应;
(3)煅烧碳酸氢钠晶体产生碳酸钠、水和二氧化碳的化学方程式:2NaHCO3![]() CO2↑+H2O+ Na2CO3;
CO2↑+H2O+ Na2CO3;
(4)NaCl+NH4HCO3=NaHCO3↓(晶体)+NH4Cl(溶液),Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,Y的化学式为:NH4Cl,氯化铵中含有氮元素,农业上的用途:制作氮肥;
(5)实验中要向食盐水中先通入氨气再通入气体CO2,原因是:氨气极易溶于水,使溶液呈碱性后吸收更多的气体CO2,工业产量大;
故选:B。
(6)工业的流程中,溶液中析出碳酸氢钠而没有析出氯化铵的原因是:碳酸氢钠的溶解度比氯化铵的溶解度小,碳酸氢钠先析出;
(7)煅烧碳酸钠晶体时产生二氧化碳气体能与饱和的氯化钠溶液反应;同时氯化铵溶液与氢氧化钙共热产生氨气也能与饱和的氯化钠溶液反应;所以循环利用的物质是H2O、氨气和二氧化碳。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示。试求:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
(1)m的值为_____g。
(2)12 g石灰石样品中碳酸钙的质量为____g。
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1%)________