题目内容
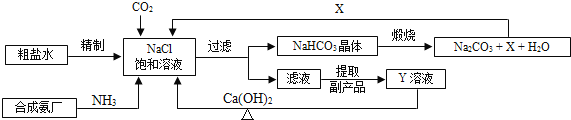
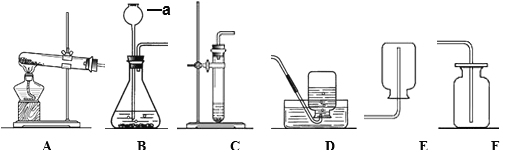
【题目】某粗盐中含有少量CaCl2、MgSO4等可溶性杂质,下图是提纯粗盐的实验流程:

(1)滤渣X的主要成分为_______________(填化学式)。
(2)试剂a为___________,实验过程中判断加入的试剂a恰好发生完全反应的方法是_____________,该反应的化学方程式为______________。
(3)操作Ⅰ是_______(填名称),写出该操作需用到的其中1种仪器名称________。
【答案】Mg(OH)2、BaSO4 稀盐酸 滴入试剂至刚好无气泡产生 Na2CO3+2HCl=2NaCl+CO2↑+H2O 蒸发 蒸发皿
【解析】
粗盐中含有氯化钙、硫酸镁杂质,加入过量氢氧化钡后生成硫酸钡沉淀和氢氧化镁沉淀,则此时滤液的溶质为氯化钠、氯化钙、氢氧化钡。加入过量的碳酸钠,则碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,则此时滤液的溶质为氯化钠、氢氧化钠、碳酸钠。加入试剂a后,得到精盐水,则该过程中,试剂a可以除去氢氧化钠、碳酸钠,则试剂a为稀盐酸。加入适量的稀盐酸后,可以将杂质氢氧化钠、碳酸钠除去,并得到氯化钠溶液。
(1)粗盐中含有少量的氯化钙和硫酸镁。加入氢氧化钡后,氢氧化钡和氯化钙不反应,氢氧化钡和硫酸镁反应生成硫酸钡沉淀和氢氧化镁沉淀。则滤渣X的主要成分是硫酸钡沉淀和氢氧化镁沉淀。故答案为:Mg(OH)2、BaSO4;
(2)通过分析可知,试剂a为稀盐酸。由于稀盐酸加入后会优先和氢氧化钠发生中和反应,生成氯化钠和水。待氢氧化钠被消耗尽后,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳。所以判断稀盐酸加入后恰好和杂质完全反应的依据是滴入试剂稀盐酸至恰好无气泡产生。故答案为:滴入试剂至刚好无气泡产生、Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(3)得到精盐水后经过操作Ⅰ可以得到氯化钠晶体,则该操作为蒸发。蒸发的过程中会用到铁架台、酒精灯、蒸发皿、玻璃棒等实验仪器。故答案为:蒸发、蒸发皿(答案合理即可)。

【题目】实验小组以鸡蛋壳(主要成分CaCO3,在水中能溶解出微量的Ca2+,其他成分对实验影响忽略不计)为牙齿的替代物,模拟含氟牙膏保护牙齿的化学原理。
(查阅资料)①含氟牙膏保护牙齿的原因:含氟牙膏中的NaF能与牙齿表面溶解的微量Ca2+反应,生成更难溶于酸的物质。
②常温下,酚酞溶液遇pH<8.2的碱性溶液不变色。
(进行实验)实验小组用2种不同的方法进行实验。

实验一:如图连接仪器,进行实验。
实验组 | 对照组 | |
锥形瓶中的物质 | 0.5g用含氟牙膏处理过的鸡蛋壳 | 0.5g未用含氟牙膏处理过的鸡蛋壳 |
注射器中的物质 | 20mL3.5%的盐酸 | m |
试管中的物质 | 滴有酚酞的氢氧化钠稀溶液 | 滴有酚酞的氢氧化钠稀溶液 |
试管中溶液褪色时间(s) | t1 | t2 |
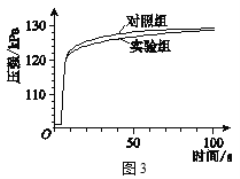
实验二:如图连接仪器,锥形瓶和注射器中的物质均与实验一相同。进行实验,测量压强随时间的变化
如图所示。
(解释与结论)
(1)装入药品前,检查装置a的气密性:用止水夹夹住右侧橡皮管,______,说明装置气密性良好。
(2)实验一中:
①鸡蛋壳中主要成分与盐酸反应的化学方程式为______。
②m处应填写的是______。
(3)实验二能证明含氟牙膏对鸡蛋壳有保护作用,其理由是______。由此推断出实验一中,t1______t2(填“>”、“<”或“=”)。
(反思与评价)
(4)根据本实验模拟的含氟牙膏保护牙齿的化学原理,推测下列摩擦剂一定不能用于制作含氟牙膏的是______(填序号)。
A CaCO3 B SiO2(二氧化硅) C Al(OH)3