题目内容
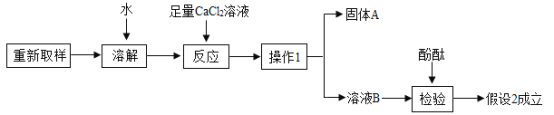
【题目】测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.
(已知CaCO3+2HCl═CaCl2+H2O+CO2↑杂质不参与反应,也不溶于水)
(1)石灰石样品中碳酸钙的质量是 g
(2)石灰石样品中碳酸钙的质量分数是
(3)计算稀盐酸溶质的质量分数。
【答案】(1)2克(2)80%(3)14.6%
【解析】
根据图示可知固体质量的减少量就是参加反应的碳酸钙质量,所以石灰石样品中碳酸钙的质量是=2.5克-0.5克=2克;所以石灰石样品中碳酸钙的质量分数是=2克/2.5克×100%=80%;设:恰好反应时,氯化氢的质量为x
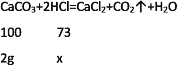
列比例式得:100:2克=73:X 解得X=1.46g.
稀盐酸溶质的质量分数为1.46克/10克×100%=14.6%

 名校课堂系列答案
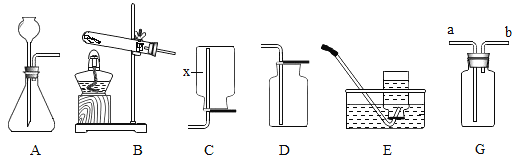
名校课堂系列答案【题目】我国大部分地区深受酸雨危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成亚硫酸(H2SO3)。已知:H2SO3易分解成水和SO2,也易于空气中的氧气反应生成H2SO4;H2SO3和SO2都能使红色品红溶液褪色;BaSO3可以被硝酸氧化为BaSO4。
(1)酸雨是pH小于_________的降雨。
(2)常用脱硫方法减少废气中的SO2:以生石灰(CaO)为脱硫剂,高温下与废气中的SO2和O2化合生成CaSO4,化学反应方程式为___________________。
(3)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH溶液,并反应后混合溶液中盐的成分进行了如下探究:
(提出问题)反应后混合溶液中盐的成分是什么?
(提出猜想)猜想1:只有K2SO3;猜想2:只有_________;猜想3:既有K2SO3又有K2SO4。
(实验探究)限选试剂:稀盐酸、稀硫酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液。
步骤 | 实验操作 | 预期现象与结论 |
1 | 各取2mL反应后的溶液分别加入A、B两支试管中 | |
2 | 向A试管中加入足量稀硫酸,随机加入几滴红色品红溶液 | ______,证明含有K2SO3 |
3 | 向B试管中加氯化钡溶液,再加足量的_______。 | 现有白色沉淀产生,后有气泡产生,沉淀部分溶解,则猜想3成立。 |
【题目】能源、食品健康、环境问题是全球化的热点。下列观点或做法完全正确的是( )
A.保护空气 | B.爱护水资源 |
a.禁燃烟花爆竹-降低 b. | a.用淘米水浇花-节约用水 b.活性炭净水-利用吸附性 |
C.食品健康 | D.能源利用 |
a.保鲜海产品-用甲醛溶液浸泡 b.延长食品保质期-添加大量的防腐剂 | a.发现大陆可燃冰-缓解能源危机 b.推广车用乙醇汽油-零尾气污染 |
A.AB.BC.CD.D