��Ŀ����
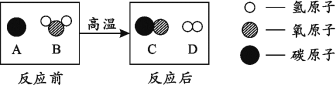
����Ŀ��R ������ػ��Ȼ���е�һ�֡�����ػ��Ȼ�淋��ܽ��������ͼ 1 ��ʾ��������ͼ 2 ��ʾʵ�顣
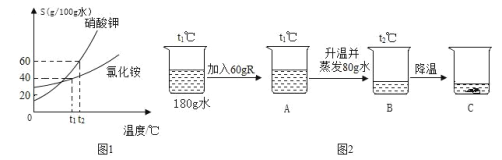
�� t1 ��ʱ���Ȼ�淋��ܽ��Ϊ_________��
�� A �ձ�����Һ��������������Ϊ_________��
�۸���������Ϣ���Ƴ� R ��_______��д���ƻ�ѧʽ���ɣ���
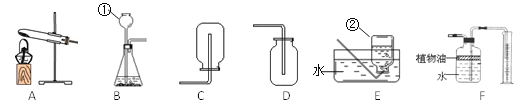
�ܹ���ͼ 2 ���ձ��ڵ����ʣ����¼���˵����ȷ����_____��
a.A��B��C �У�ֻ�� C ���ϲ���Һ�DZ�����Һ
b.��ʹ C �еĹ����ܽ⣬�ɲ��ü�ˮ�����µķ���
c.A �� B ����Һ�У������������
d.A ����Һ��������������һ���� C ���ϲ���Һ��������������С
���𰸡�40g/100gˮ 25% KNO3������� bc
��������
(1)t1 ��ʱ���Ȼ�淋��ܽ���Ǻ�����Ϊt1 ��ʱ�����������ֵ���ʴ˿���д40g/100gˮ��
(2)A �ձ�������ʣ�����A �ձ�����Һ��������������Ϊ![]() X100%=25%��
X100%=25%��
(3)��ͼ1��֪��t2 ��ʱ������ص��ܽ��Ϊ60 g/100gˮ���Ȼ�淋��ܽ�ȱ���С��ͼ2ͨ�����²�����80gˮ�õ�����ҺB���������ʣ����ԣ�ֻ�����������Һ����R ������ػ�KNO3��
(4)a��A��B��C �У�B�� C ���ϲ���Һ�DZ�����Һ���ʲ��������⣻
b����ͼ1��֪������ص��ܽ�����¶����ߣ����������ԣ���ʹ C �еĹ����ܽ⣬�ɲ��ü�ˮ�����µķ������ʷ������⣻
c��A��Һת��ΪB��Һ�Ĺ����У�����û��������Ҳû���������ʣ����ԣ�A��B����Һ�У�����������ȣ��ʷ������⣻
d����ΪC ���ϲ���Һû�о���˵���¶ȣ����ԣ���ȷ������������������������������������ʲ���������

����Ŀ��ij��ȤС��ͬѧ��ʵ�����Ʊ�������������������̽��ʵ�顣
��Ϊ̽�����������������طֽ����ʵ�Ӱ�죬��������¶Ա�ʵ�飺
��� | ʵ��ҩƷ | �ֽ��¶�(��) |
�� | 3.0gKClO3��1.0gMnO2���Ȼ�ϼ��� | 350 |
�� | xgKClO3��1.0gCuO���Ȼ�ϼ��� | 370 |
���з�Ӧ�Ļ�ѧ����ʽ��_______��
����x��ֵӦΪ________��
[ʵ�����]ʵ���������ֽ����������У���Ч����õ���_______��
����̽����Ӱ��˫��ˮ�ֽ����ʵ�ij�����أ�ʵ�����ݼ�¼���£�
˫��ˮ������ | ˫��ˮ��Ũ�� | MnO2������ | ��ͬʱ���ڲ���O2��� | |
�� | 50.0g | 1% | 0.1g | 9mL |
�� | 50.0g | 2% | 0.1g | 16mL |
�� | 50.0g | 4% | 0.1g | 31mL |
��ʵ���У�����O2�����װ����______(����)��
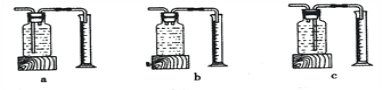
[ʵ�����]����ͬ�����£�_______��˫��ˮ�ֽ��Խ�졣
[��˼]������ͼװ�ý���ʵ�飬ͨ���Ƚ�_____Ҳ�ܴﵽʵ��Ŀ�ġ�