题目内容
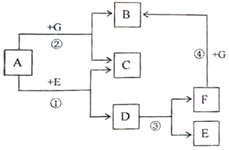
【题目】A,B,C,D,E均是初中化学常见物质,A,C,D均为非金属单质,其中D为黑色固体,A,C通常状况下为气休;B为实验室中用来制取氧气的白色固体;E通常情况下为无色,无味的液体。图中的“—”表示两端的物质间能发生化学反反应,“→”表示物质间存在转化关系。它们之间的部分反应及转化关系如下图所示(图中反应条件及部分反应物、生成物已省略)。
回答下列问题:
(1)请写出以下物质的化学符号: C_________,D__________;
(2)物质B转化为A的化学方程式为__________________;
(3)物质A转化为E的化学方程式_________________;
(4)A物质的用途是_______________。
【答案】H2 C 2KClO3![]() 2KCl+3O2↑ 2H2+O2
2KCl+3O2↑ 2H2+O2![]() 2H2O 供给呼吸
2H2O 供给呼吸
【解析】
A、B、C、D、E均是初中化学常见物质,A,C,D均为非金属单质,其中D为黑色固体,A,C通常状况下为气体,B为实验室中用来制取氧气的白色固体,所以B是氯酸钾,E通常情况下为无色,无味的液体,A和E可以互相转化,所以A是氧气,E是水,D、E会与氧气反应,所以D是碳,C是氢气,经过验证,推导正确。
由分析可知(1)所以C是H2,D是C;
(2)物质B转化为A的反应是氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)物质A转化为E的反应是氢气和氧气在点燃的条件下生成水,化学方程式为:2H2+O2![]() 2H2O;
2H2O;
(4)通过推导可知,A物质是氧气,用途是供给呼吸。

【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
编号 | 实验药品 | 分解温度(℃) |
Ⅰ | 3.0gKClO3与1.0gMnO2均匀混合加热 | 350 |
Ⅱ | xgKClO3与1.0gCuO均匀混合加热 | 370 |
Ⅰ中反应的化学方程式是_______;
Ⅱ中x的值应为________。
[实验结论]实验所用两种金属氧化物中,催化效果最好的是_______。
②乙探究了影响双氧水分解速率的某种因素,实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
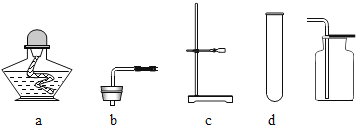
本实验中,测量O2体积的装置是______(填编号)。
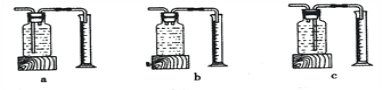
[实验结论]在相同条件下,_______,双氧水分解得越快。
[反思]丙用如图装置进行实验,通过比较_____也能达到实验目的。

【题目】海洋是地球上最大的储水库。蕴含着丰富的化学资源,开发前景十分远大:
(1)目前海水淡化普遍采取的方法是_____。
(2)海水晒盐能够得到粗盐,某兴趣小组同学选取一些粗盐样品,想制得较纯净的精盐,进行如下实验探究:
步骤一:除去泥沙等难溶性杂质、操作的主要步骤为溶解,过滤、_____,在最后一步中玻璃棒的作用为_____;
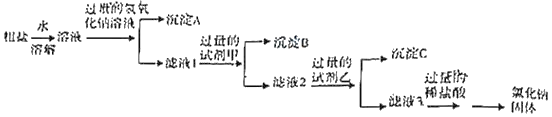
步骤二:除去步骤一所得粗盐中的可溶性杂质氯化镁、氯化钙、碳酸钠,采用如图所示流程:
写岀试剂甲溶液的溶质是_____,沉淀C的成分是_____;(均填化学式)
某同学通过对滤液3成份的检验与分折,确定杂质氯化镁、氯化钙、硫酸钠已被完全去除干净,设计实验方案如下:
实验操作步骤 | 实验现象 | 实验结论 |
步骤一:取少量滤液3于试管中,加入足量_____;过滤,向白色沉淀中加入过量稀硝酸 | 产生白色沉淀;白色沉淀全部溶解 | 证明滤液3中含有_____,没有氯化钙和硫酸钠 |
步骤二:向步骤一反应后所得滤溶液中加入无色酚酞 | 溶液变红 | 证明滤液中含有_____,没有氯化镁 |