题目内容
【题目】为测定一瓶氢氧化钠溶液的质量分数,小张同学进行了以下实验:
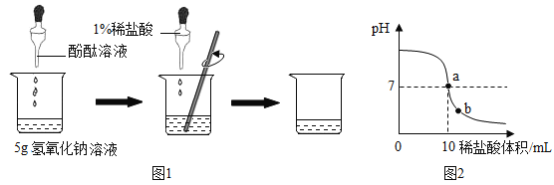
如图1所示,在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
(1)当溶液颜色恰好变为无色时,共用去稀盐酸7.3g,则该氢氧化钠溶液中溶质的质量分数为_____%。
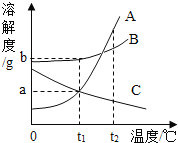
(2)在以上实验操作中,如继续滴加1%稀盐酸,并不断搅拌,则整个实验过程中溶液pH的变化曲线如图2所示。
①a点表示的含义是_____;
②b点表示的溶液中含有的阳离子有_____(填离子符号)。
(3)实验用到的盐酸有多种用途,请你写出一种_____。
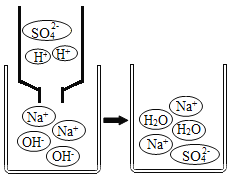
(4)不仅盐酸和氢氧化钠能发生中和反应,其它的酸和碱也能发生类似反应,写出如下图所示的化学方程式:_____;该类反应的实质是_____。
【答案】1.6% 氢氧化钠与稀盐酸恰好完全反应产生氯化钠(中性)溶液 Na+ H+ 制取二氧化碳气体 H2SO4+2NaOH=Na2SO4+2H2O 氢离子与氢氧根离子反应产生水
【解析】
(1)当溶液颜色恰好变为无色时,共用去稀盐酸7.3g,则稀盐酸中溶质的质量=7.3g×1%=0.073g;
解:设该氢氧化钠溶液中溶质的质量为x。

![]()
x=0.08g
该氢氧化钠溶液中溶质的质量分数=![]() ;
;
(2)①a点,pH=7,溶液显中性,表示的含义是:氢氧化钠与稀盐酸恰好完全反应产生氯化钠(中性)溶液;
②b点,pH<7,溶液显酸性,含有氢离子,且原溶液中有钠离子,表示溶液中含有的阳离子有:Na+ H+;
(3)实验用到的盐酸有多种用途,可以用稀盐酸与大理石反应制取二氧化碳气体;
(4)不仅盐酸和氢氧化钠能发生中和反应,其它的酸和碱也能发生类似反应,硫酸和氢氧化钠反应产生硫酸钠和水的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O;该类反应的实质是:氢离子与氢氧根离子反应产生水:H++OH-=H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
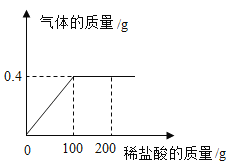
期末集结号系列答案【题目】某校学习小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品10g加入烧杯中,再把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 7 | 4 | 2.6 | m |
分析表中数据,完成下列问题:
(1)表中m的数值为_____g;
(2)该石灰石样品中碳酸钙的质量分数为_____;
(3)计算反应所用稀盐酸溶质质量分数_____。