��Ŀ����
����Ŀ���ס������ֹ������ʵ��ܽ��������ͼ��ʾ���ش��������⣺
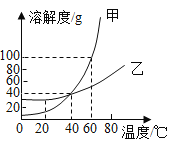
��1��20��ʱ���Ƚϼס��������ʵ��ܽ�ȣ���_____�ң��������=����������
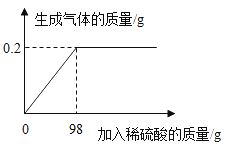
��2��60��ʱ����100g�ļ����ʼ���50gˮ�У�����ܽ⣬�õ���Һ������Ϊ_____g��
��3��40��ʱ�������ʵı�����Һ�����ʵ���������Ϊ_____���������ȷ��0.1%��
��4����ҵ�Ͻ����ҵ��Ȼ����Һ�����߾��Ѵﱥ�ͣ���ȴ�����£��������壬���˺�õ���Һ���й���Һ��˵����ȷ����_____��
A ֻ�����ң������ף����Ҵﵽ����
B �����ң��ֺ��мף���ֻ���Ҵﵽ����
C �����ң��ֺ��мף������߶��ﵽ����
���𰸡��� 100 28.6% C
��������
��1�����ܽ������ͼ��֪��20��ʱ���Ƚϼס��������ʵ��ܽ�ȣ��ף��ҡ�
��2��60��ʱ�������ʵ��ܽ��Ϊ100g����100g�ļ����ʼ���50gˮ�У����ֻ���ܽ��50g����ף���õ���Һ������Ϊ50g+50g=100g��
��3��40��ʱ�������ʵ��ܽ��Ϊ40g���������ʵı�����Һ�����ʵ���������=![]() ��
��
��4�������ʵ��ܽ�����¶ȵ�Ӱ��ϴ������ʵ��ܽ�����¶ȵ�Ӱ���С�����º��������ʵ��ܽ�ȶ���С����ҵ�Ͻ����ҵ��Ȼ����Һ��ȴ�����£������������壬�Һ��������壬���˺�õ���Һ��Ϊ������Һ��
��ѡ��C��

 ��ս�п�����ϵ�д�
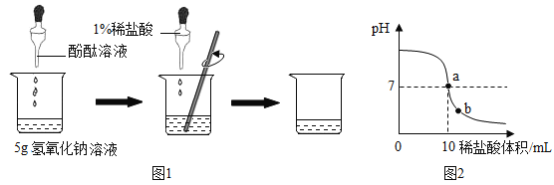
��ս�п�����ϵ�д�����Ŀ���ס����������ʵ��ܽ��������ͼ��ʾ������˵����ȷ����

A�����ס��ҵı�����Һ��t2���ֱ��µ�t1�������������������һ�������� |
B��t1��ʱ�ס��ҵı�����Һ����������������� |
C��t2��ʱ��40g������100gˮ�У��γɱ�����Һ |
D����M��ļ���Һ��ɱ�����Һ����ȡ�ķ�����__________________________�� |
����Ŀ������һ�����ڣ��ϴ�ͬѧ�ͼ��˵�����ʡ�����ȥ�ιۣ����ֲ����������ͭ��Ʒ������һ����ɫ���ʡ���ɫ������ʲô�����������γɵģ���ѧ����ϣ�ͬѧ�����ʵ���������ɫ���ʽ���������̽�����
���������ϣ�
��ͭ�ڿ�����������ͭ�⣬��Ϊ��ɫ������Ҫ�ɷ���Cu2��OH��2CO3��
�ڰ�ɫ������ͭ��ĩ��ˮ�ܱ�Ϊ��ɫ��
̽���һ����֤ͭ�����ɡ�
������ʵ��1��
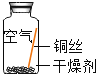
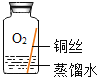
ͬѧ���������ͼ��ʾװ�ò�����ʵ�顣
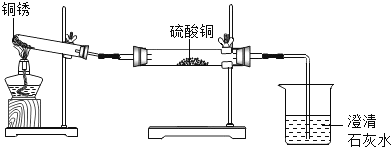
ʵ����� | ʵ������ | ʵ����� |
�ٰ���ͼ��װ������װ��ҩƷ�� �ڼ���ͭ�⣬ֱ�����������������ֹͣ���� | ��ɫ�����Ϊ��ɫ������ͭ��ĩ��Ϊ��ɫ���ձ���Һ������ | ����ͭ�����ɵ�������_____�� |
����ȴ�����Թ��й����������ϡ���ᣬ�Լ��� | ��ɫ�����ܽ⣬��Һ��Ϊ��ɫ | ������Ӧ�Ļ�ѧ����ʽΪ��_____�� |
̽�������̽��ͭ�����������
������ʵ��2��
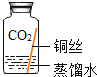
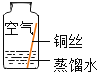
ͬѧ�ǽ����������4��ʵ�飬ÿ��۲�һ������һ��ʱ�����ֻ��ʵ��4�е�ͭ˿�����ˣ�����ˮ�Ӵ��IJ�����������ԡ�
��� | ʵ��1 | ʵ��2 | ʵ��3 | ʵ��4 |
ʵ������ |
|
|
|
|
ʵ������ | �ڸ��ﻷ���У�ͭ������ | ͭ����������ˮ�Ӵ��������� | ͭ���������̼��ˮ�Ӵ��������� | ͭ���� |
span>
��ʵ����ۣ�ͭ�����������_____��
����˼����չ��
��1��ʵ��2��3��ʹ�õ��Ǿ���к�Ѹ����ȴ������ˮ����Ŀ����_____��
��2�����Ҫ��ȥͭ��Ʒ�����ͭ�⣬������ϡ������ݣ�д����Ӧ�Ļ�ѧ����ʽ_____��
����Ŀ���±���NaOH��Ca(OH)2���ܽ�����ݣ���ش��������⣮
�¶ȣ��棩 | 0 | 20 | 40 | 60 | 80 | 100 | |
�ܽ�ȣ�g�� | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
��1���ӱ������ݿ��Ի�õ���Ϣ��__________��дһ������
��2����80��ʱNaOH�ı�����Һ������20�棬���Կ�����������__________����ʱ��Һ��������������Ϊ__________��������һλС����
��3��ij��ȤС��Բ��ֱ��ʵ��������ƹ�������ᴿ����������²������̣���ش�

��������м������Ca(OH)2��Ŀ����__________���漰��Ӧ�Ļ�ѧ����ʽΪ__________��
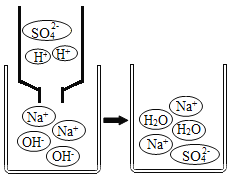
������ҺB�е�������__________��д��ѧʽ����������������ľ�������Ǽ���Ũ����__________�����ˣ�
������ʵ��ǰ�Ƶ���Ʒ������Ϊ10g��ʵ���Ƶ�������A������NaOH�������������ֱ���5g��8.7g�������Ʒ�Ĵ���Ϊ__________��