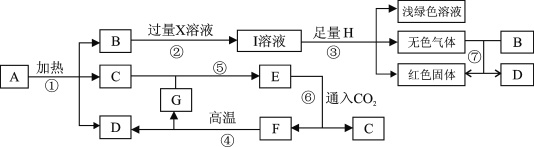
题目内容
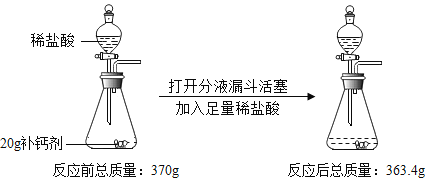
【题目】为测定粗锌样品中锌的质量分数,称取20 g粗锌样品(杂质不溶于水也不参加反应)与足量的稀盐酸反应。所加稀盐酸的质量与产生气体的质量关系如图所示。求:
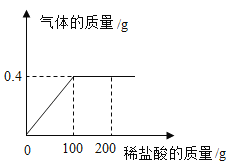
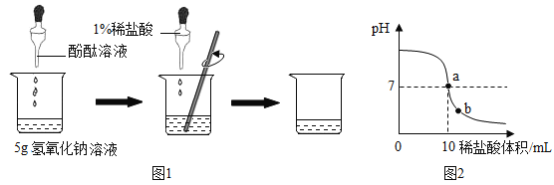
(1)此过程中产生气体的最大质量是________g。
(2)粗锌样品中金属锌的质量分数为_______?(写出计算过程)
(3)若用36.5%的浓盐酸配制200 g该实验所用稀盐酸,需要水的质量为________。
【答案】0.4 65% 120 g
【解析】
(1)根据图示可知,此过程中产生气体的最大质量是0.4g;
(2)根据图示可知,100g的稀盐酸与20 g粗锌恰好完全反应生成0.4g的氢气。
设20 g粗锌样品中锌的质量为x。100g盐酸中溶质的质量为y。

![]() x=13 g;
x=13 g;
![]() y=14.6g
y=14.6g
粗锌样品中金属锌的质量分数=![]() ;
;
盐酸的溶质质量分数=![]()
答:粗锌样品中金属锌的质量分数为65%。
(3)设需要水的质量为z。
稀释前后溶质的质量不变,则有:
200g×14.6%=36.5%(200-z) z=120 g。

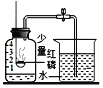
【题目】用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40℃。
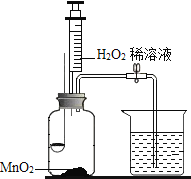
内容步骤 | (实验1)研究燃烧条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液(能吸收CO2),燃烧匙中放入木炭 点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
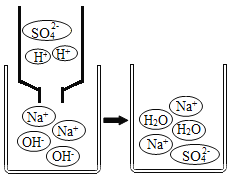
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为____________________。
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是________、_________;推入H2O2溶液打开止水夹,观察到烧杯中的现象是_________。
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是__________;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶。该实验中,集气瓶内压强的变化过程是___________。
(4)下面是一些常用的灭火方法的事例:
①熄灭酒精灯时,用灯帽盖灭;②熄灭燃气灶火焰时,关闭阀门;③油锅着火时,用锅盖盖灭;④森林着火时,将大火蔓延线路前的一片树木砍掉;⑤房屋着火时,用高压水枪灭火。请你从灭火原理角度,选择一种分类标准进行分类:分类标准________,包括事例_________(填序号)。
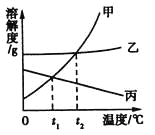
【题目】如表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度 | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 | 氯化钠 |
|
|
|
|
|
|
硝酸钾 |
|
|
| 110 | 169 | 246 | |
氢氧化钙 |
|
|
|
|
|
| |
![]() 时,氯化钠的溶解度______硝酸钾的溶解度
时,氯化钠的溶解度______硝酸钾的溶解度![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() “
“![]() 。
。
![]() 表中某物质的饱和溶液随温度升高析出固体,该物质是______
表中某物质的饱和溶液随温度升高析出固体,该物质是______![]() 填化学式
填化学式![]() 。
。
![]() 向
向![]() 的氢氧化钙饱和溶液中加入少量生石灰,再冷却至
的氢氧化钙饱和溶液中加入少量生石灰,再冷却至![]() ,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量______
,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量______![]() 填“增大”“不变”或“减小”
填“增大”“不变”或“减小”![]() 。
。
![]() 混有少量氯化钠的硝酸钾固体,加水配成
混有少量氯化钠的硝酸钾固体,加水配成![]() 的硝酸钾饱和溶液,再冷却至
的硝酸钾饱和溶液,再冷却至![]() ,析出晶体并得到溶液。下列有关说法中正确的是______
,析出晶体并得到溶液。下列有关说法中正确的是______![]() 填字母
填字母![]()
A 析出的晶体中不一定含有硝酸钾
B 所得溶液一定是硝酸钾饱和溶液
C 上述方法可以将两种物质完全分离