题目内容
【题目】水和溶液是生活中常见的物质,请按要求回答问题。

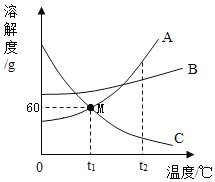
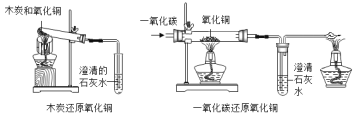
(1)如图1三个操作中,能够证明水是由氢、氧元素组成的是______(填序号)。图C活性炭的作用的是______________。
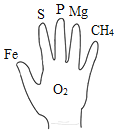
(2)从微观角度解释图A与图B中所发生的变化的本质不同是:__________________________。
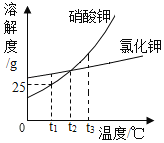
(3)如图2为甲、乙、丙三种固体物质的溶解度曲线如图所示,改变温度(不考虑溶剂变化):
①在t1 ℃时,三种物质的饱和溶液分别从t1 ℃升温到t3 ℃,三种物质的溶质质量分数的大小顺序为______。
②在t3 ℃时,甲、乙、丙三种物质分别在100 g的水中配成饱和溶液,从t3 ℃降温到t1 ℃时,析出固体的质量大小关系为____________。
③t3 ℃时,甲的饱和溶液中溶质与溶液质量比为____________。
(4)水是重要的溶剂,用10%氯化钠溶液配制2%的氯化钠溶液500 g,需要向10%的氯化钠溶液加水。____________
【答案】B 吸附水中色素和异味 A中分子间隔发生了变化,B中分子种类发生了变化 乙>甲>丙 甲>乙>丙 4:9 400g
【解析】
(1)水在通电的条件下生成氢气和氧气,说明了水是由氢、氧元素组成的;图C活性炭具有吸附性,可以吸附水中色素和异味;
(2)从微观角度解释图A与图B中所发生的变化的本质不同是:A中分子间隔发生了变化,B中分子种类发生了变化;
(3)①在t1℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等,升高温度,甲、乙物质的溶解度增大,丙物质的溶解度减小,应该按照t3℃时的溶解度计算,所以三种物质的饱和溶液分别从t1℃升温到t3℃,三种物质的溶液中溶质质量分数的大小顺序为:乙>甲>丙;
②在t3℃时,甲、乙、丙三种物质分别在100g的水中配成饱和溶液,从t3℃降温到t1℃时,甲物质的溶解度变化最大,丙物质的溶解度随温度的降低而增大,没有固体析出,所以析出固体的质量大小关系为:甲>乙>丙;
③t3℃时,甲物质的溶解度是80g,所以饱和溶液中溶质与溶液质量比为:80g:180g=4:9;
(4)用10%氯化钠溶液配制2%的氯化钠溶液500 g,设需要10%的氯化钠溶液的质量为x,则x×10%=500g×2%,x=100g,故需要加水的质量为:500g-100g=400g。
故答案为:(1)B;吸附水中色素和异味;
(2)A中分子间隔发生了变化,B中分子种类发生了变化;
(3)①乙>甲>丙;②甲>乙>丙;③4:9;
(4)400g。

【题目】阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,是餐桌上的美味食材。

表1鲜土豆中主要营养物质的含量(每100g)
蛋白质/g | 脂肪/g | 淀粉/g | 钙/mg | 磷/mg | 维生素C/mg |
1.5~2.3 | 0.4~0.94 | 17.5~28.0 | 11~60 | 15~68 | 20~40 |
土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。用土豆片进行实验,测得其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:

土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位削掉,也不宜食用。除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
依据文章内容回答下列问题。
(1)表1中的“钙”指的是________(填“元素”或“原子”)。
(2)由图1可知:60min内,______(填序号)。
A浸泡30min比10min脆性分值高
B浸泡10min,硬度、咬碎感均无明显变化
C随着浸泡时间的增加,粘结性、弹性分值均降低
(3)由图2可知:土豆片的淀粉含量与浸泡时间的关系是________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________。
(5)下列说法不正确的是____(填序号)。
A土豆是四大粮食作物之一 B土豆中维生素C含量最高
C用水泡可防止土豆片褐変 D土豆开发应用的前景广阔
【题目】化学兴趣小组的甲、乙、丙三位同学发现实验台上有一瓶标签残缺的试剂(如图),他们对此进行了如下探究。
![]()
(提出问题)这是一瓶什么溶液?
(猜想与假设)甲同学的猜想是Na2SO3溶液;乙同学的猜想是Na2SO4溶液,你的猜想是____(写化学式,只写一种)。
(查阅资料)
(1)白色沉淀BaSO3不溶于水,但能溶于稀盐酸。
(2)硝酸具有强氧化性,能将BaSO3被氧化成BaSO4。
(3)Na2SO3与稀盐酸反应产生无色气体SO2,SO2能使澄清石灰水变浑浊,也能使品红溶液褪色。
(进行实验)
I.甲同学取适量的该溶液于试管中,滴加稀盐酸产生无色气体,甲同学认为自己的猜想成立,而乙同学认为甲的结论不合理,原因是______________________________________________。
II.乙同学为了验证自己的猜想,做了如下实验:
取适量的该溶液于试管中,先滴加足量的BaCl2溶液,再滴加过量稀硝酸,现象为___________,乙同学认为自己的猜想成立。
III.激发丙同学对乙同学的猜想又提出了质疑,丙认为加BaCl2和稀硝酸,Na2SO3也能产生沉淀,为了验证自己的观点,做了如下实验:
步骤 | 操作 | 实验现象 | 实验结论 |
步骤1 | 取少量该溶液于试管中滴加足量的BaCl2溶液 | ______。 | 无 |
步骤2 | 向步骤1的试管中滴加足量的稀盐酸溶液 | _____。 | 此溶液不是Na2SO4溶液。 |
步骤3 | 将步骤2中产生的气体通入品红溶液 | 品红溶液褪色。 | ____。 |
写出丙同学实验过程中的化学方程式:____________________________,_____。