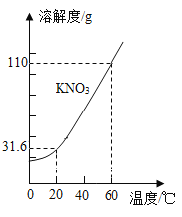
题目内容
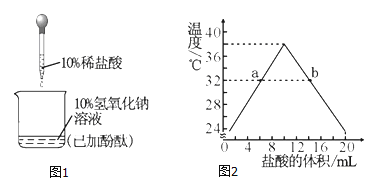
【题目】下图是三种常见固体物质的溶解度曲线,下列说法正确的是()
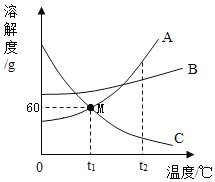
A.t1℃时,A和C的饱和溶液中含有相同质量的溶质
B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C.t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量为70g
D.t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C
【答案】C
【解析】
由三种常见固体物质的溶解度曲线图可知,A的溶解度受温度影响较大,B的溶解度受温度影响较小,C的溶解度随温度的升高而减小。
A、在t1℃时,A的溶解度等于C的溶解度,两物质的饱和溶液中溶质的质量分数相等,因此等量的两物质的饱和溶液中含有相同质量的溶质,但并不能说A和C的饱和溶液中含有相同质量的溶质,故A不正确;
B、A的溶解度受温度影响较大,B的溶解度受温度影响较小,所以可采用降温结晶的方法除去A溶液中混有的少量B物质,故B不正确;
C、t1℃时,A的溶解度为60g,饱和溶液的质量分数为![]() ,设t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量x,
,设t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量x,![]() ,
,![]() ,需要加水的质量为70g,故C正确;
,需要加水的质量为70g,故C正确;
D、A、B的溶解度随温度的降低而降低,C的溶解度随温度的降低而升高,t2℃时,A、B、C的溶解度大小为A>B>C,将A、B、C的饱和溶液降温至t1℃,A、B的溶解度减小析出晶体,溶液中溶质质量减小,溶剂质量不变,溶质质量分数减小,C的溶解度变大,溶液中溶质、溶剂质量不变,溶质的质量分数与降温前相等,溶解度大则溶质的质量分数大,而t1℃时B的溶解度大于A的溶解度大于降温前C的溶解度,则所得溶液的溶质质量分数大小顺序为B>A>C,故D不正确。故选C。

【题目】为得到高纯度碳酸钙,实验室用Na2CO3溶液与CaCl2溶液反应制取。现将150gCaCl2溶液分四次加入盛有100gNa2CO3溶液的烧杯中,充分反应,四次测量所得数据见下表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 |
累计加入CaCl2溶液的质量/g | 40 | 80 | 120 | 150 |
烧杯中溶液的总质量/g | 134 | 168 | 202 | 232 |
(1)第___________次恰好完全反应,此时生成沉淀的总质量为___________g。
(2)第四次测量时,所得溶液中的溶质有___________(填化学式)。
(3)CaCl2溶液的溶质的质量分数为___________。(写出计算过程)