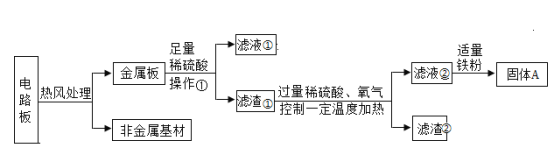
题目内容
【题目】(一) 下图所示为实验室中常见的气体制备和收集装置.
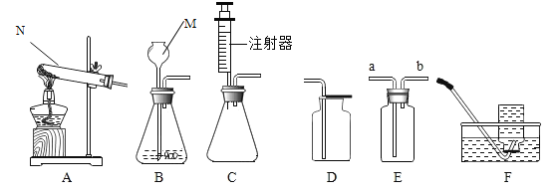
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字 母序号)。若用装置B制取二氧化碳,反应的原理是(用化学方程式表示)_____。
(2)实验室用H2O2溶液和MnO2制取氧气, 若选用C做发生装置,你认为选用C的优点是_____。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从_____ (填“a”或“b”) 端通入:欲使用装置E.用排水法收集氧气,先将瓶中装满水,再将气体从_____ (填“a”或“b”) 端通入。
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置_____(填字母序号)。
(二)小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,井向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应:②氢氧化钠有剩余:③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
实验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 | 如果_____。 | 则盐酸过量 |
如果_____。 | 则盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是_____。(填序号).
A 生锈的铁钉
B 碳酸钠粉末
C 硫酸钠粉末
D 氢氧化铜
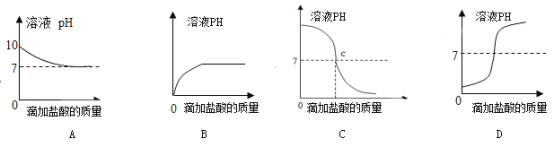
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是_____(填序号)。
【答案】A ![]() 可以控制产生氧气的速率 a b F 观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余; 有气泡冒出 没有气体生成 C C
可以控制产生氧气的速率 a b F 观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余; 有气泡冒出 没有气体生成 C C
【解析】
(一)(1)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,应选用的发生装置是固体加热型的装置A;若用装置B制取二氧化碳,反应物是碳酸钙和稀盐酸,生成二氧化碳和水和氯化钙,反应的原理是(用化学方程式表示)![]() ;
;
(2)实验室用H2O2溶液和MnO2制取氧气, 选用C做发生装置,利用注射器可以控制液体滴加的速度,从而控制反应产生氧气的速率,故优点是可以控制产生氧气的速率;
(3)欲使用装置E用排空气法收集二氧化碳,由于相同情况下二氧化碳密度比空气密度大,气体应长进短出,即从a端通入;欲使用装置E用排水法收集氧气,氧气密度比水小,先将瓶中装满水,再将气体从b端通入;
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中排水法收集装置F;
(二)(1)氢氧化钠能使酚酞变红色。向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;
(2)将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中,如果有气泡冒出,则盐酸过量;如果没有气体生成,则盐酸与氢氧化钠恰好完全反应;
(3)A、盐酸能与生锈的铁钉反应生成黄色溶液,可行;
B、碳酸钠粉末与盐酸反应能产生二氧化碳气体,可行;
C、硫酸钠粉末与盐酸不反应,不可行;
D、氢氧化铜与盐酸反应产生氯化铜和水,可行;故填:C;
(4)小红向氢氧化钠溶液中滴加一定量稀盐酸,反应开始时溶液的pH>7,随着酸的不断加人,pH不断减小,至恰好反应时pH=7,若继续滴加稀盐酸,则pH<7,根据题意反应后从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化,说明氢氧化钠无剩余,则pH应从大于7变化到等于7进而小于7,观察图像,只有C符合,故填C。

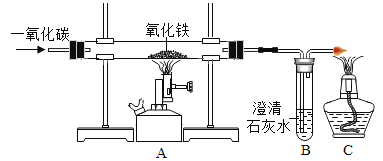
【题目】碳还原氧化铜的实验如图所示。写出该反应的化学方程式________________。
(提出问题)碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
(作出猜想)猜想①∶CO 猜想②∶CO2 猜想③∶________________。
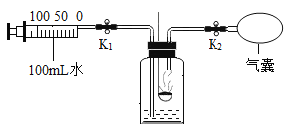
(设计方案)实验装置如图(浓硫酸具有吸水作用)。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气∶
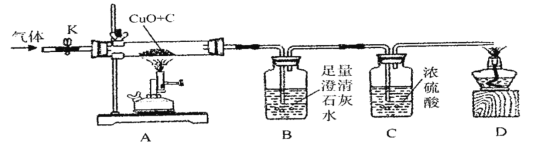
(1)实验时A处的现象是___________________。
(2)若猜想①成立,B、D处的现象是________________(填序号)。
aB中变浑浊,D处能点燃 bB中变浑浊,D处不能点燃
cB中无明显实验现象,D处能点燃 dB中无明显实验现象,D处不能点燃
方案二∶从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据∶
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B+C(广口瓶+混合液) | m3 | m4 |
(3)若猜想②成立,则理论上(m4一m3)__________(m1-m2)(选填“<”、“>”或“=”)。
(交流反思)实验开始前缓缓通入氮气的目的是_____________________。
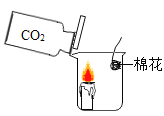
【题目】在今年五校“庆元旦 贺新年”联欢晚会上,戴校长给同学们表演了一个魔术:大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠(Na2O2)的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来。这出乎意料的现象引起了同学们的极大兴趣,请你参与同学们的讨论和探究。
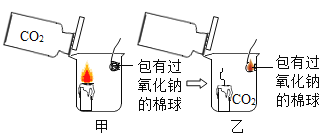
蜡烛熄灭的原因是_____。
(提出问题)棉花为什么会燃烧?
(提出猜想)
(1)可能是蜡烛燃烧引燃了棉花。
(2)可能是二氧化碳与过氧化钠反应生成了氧气。
(3)_____。
(实验验证)
序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
① | 按下图所示装置进行实验
| 蜡烛慢慢熄灭 | 猜想(1)不成立 |
② | 向盛满二氧化碳的集气瓶中加入适量的过氧化钠粉末,充分振荡,并将带火星的木条伸入集气瓶中。 | 带火星的木条复燃 | 二氧化碳与过氧化钠反应生成了氧气 猜想(2)成立 |
③ | _____ | _____ | 猜想(3)成立 |
(实验结论)
(1)CO2 与 Na2O2 反应生成了氧气与一种化合物,化学方程式为_____。
(2)通常 CO2 可作灭火剂,但有些物质(如 Na2O2)着火,不能用 CO2 熄灭。
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法错误的是
物质 | a | b | c | d |
反应前质量(g) | 10 | 10 | 10 | 2 |
反应后质量(g) | 待测 | 2 | 21 | 2 |
A.该反应是化合反应,d可能是催化剂
B.a、b两种物质中元素种类一定与c物质中元素种类相同
C.b物质可能是单质
D.反应后a物质的质量为3g