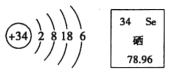
题目内容
【题目】在今年五校“庆元旦 贺新年”联欢晚会上,戴校长给同学们表演了一个魔术:大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠(Na2O2)的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来。这出乎意料的现象引起了同学们的极大兴趣,请你参与同学们的讨论和探究。
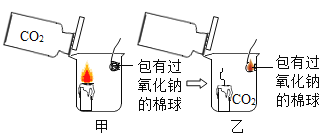
蜡烛熄灭的原因是_____。
(提出问题)棉花为什么会燃烧?
(提出猜想)
(1)可能是蜡烛燃烧引燃了棉花。
(2)可能是二氧化碳与过氧化钠反应生成了氧气。
(3)_____。
(实验验证)
序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
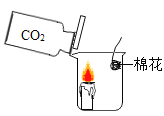
① | 按下图所示装置进行实验
| 蜡烛慢慢熄灭 | 猜想(1)不成立 |
② | 向盛满二氧化碳的集气瓶中加入适量的过氧化钠粉末,充分振荡,并将带火星的木条伸入集气瓶中。 | 带火星的木条复燃 | 二氧化碳与过氧化钠反应生成了氧气 猜想(2)成立 |
③ | _____ | _____ | 猜想(3)成立 |
(实验结论)
(1)CO2 与 Na2O2 反应生成了氧气与一种化合物,化学方程式为_____。
(2)通常 CO2 可作灭火剂,但有些物质(如 Na2O2)着火,不能用 CO2 熄灭。
【答案】与氧气隔绝 可能是过氧化钠与二氧化碳反应放出热量,引燃了棉花 向盛满CO2的集气瓶中加入适量Na2O2,用手触摸瓶壁 瓶壁温度升高或者发热,其它合理答案亦可 2Na2O2+2CO2=2Na2CO3+O2
【解析】
蜡烛熄灭的根本原因是烧杯中倒入二氧化碳后,与氧气隔绝;
[提出猜想](3)从过氧化钠和二氧化碳反应考虑:可能是过氧化钠与二氧化碳反应放出热量,引燃了棉花;
[实验验证]③向盛满二氧化碳的集气瓶中撒入适量过氧化钠,用手触摸瓶壁,发现瓶壁温度升高,说明反应放热,故猜想③成立;
[实验结论](1)过氧化钠和二氧化碳反应生成碳酸钠和氧气,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。

 名校课堂系列答案
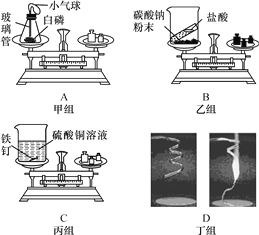
名校课堂系列答案【题目】(一) 下图所示为实验室中常见的气体制备和收集装置.
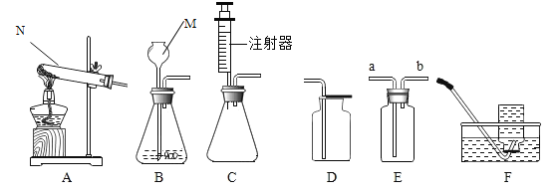
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字 母序号)。若用装置B制取二氧化碳,反应的原理是(用化学方程式表示)_____。
(2)实验室用H2O2溶液和MnO2制取氧气, 若选用C做发生装置,你认为选用C的优点是_____。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从_____ (填“a”或“b”) 端通入:欲使用装置E.用排水法收集氧气,先将瓶中装满水,再将气体从_____ (填“a”或“b”) 端通入。
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置_____(填字母序号)。
(二)小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,井向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应:②氢氧化钠有剩余:③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
实验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 | 如果_____。 | 则盐酸过量 |
如果_____。 | 则盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是_____。(填序号).
A 生锈的铁钉
B 碳酸钠粉末
C 硫酸钠粉末
D 氢氧化铜
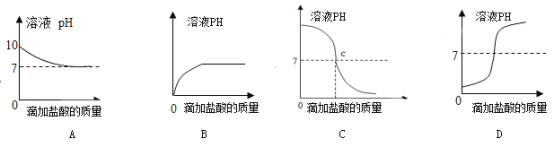
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是_____(填序号)。