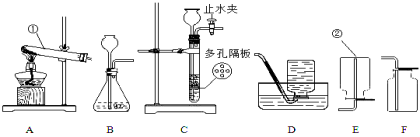
题目内容
【题目】(15分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质(不与酸反应).
②生产原理反应:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体B,并使其充分受热,可分解制得纯碱,同时得到二氧化碳和水.
③氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑.
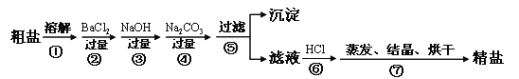
④部分生产流程如下图所示:
【问题讨论】
(1)①溶液A中的溶质有NaCl和 、 ,
②操作Ⅱ的名称为 .
③流程中Na2CO3溶液的作用是除去粗盐中的 .
④写出加入NaOH溶液与MgCl2反应的化学方程式 .
⑤晶体B受热分解的化学方程式为 .
(2)上述生产流程中可循环使用的是 (填序号).
A.NaOH B.NH3 C.HCl D.CO2
【组成探究一】
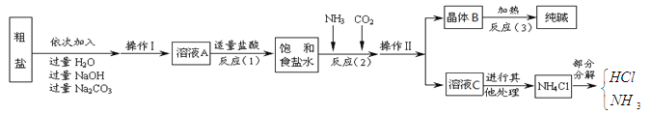
(3)设计实验检验纯碱样品中是否混有晶体B,请完成下表
选择的装置 | 实验现象 | 实验结论 |
选择的装置(填序号) | 实验现象 | 实验结论 |
样品不含晶体B |
【组成探究二】
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,由此确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
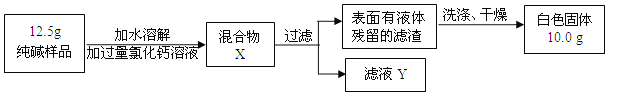
①判断加入氯化钙溶液是否过量的方法是 ,然后观察现象判断.
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观察现象判断.
A.氯化钡溶液 B.硝酸银溶液 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数是多少?(写出计算过程.3分)
【答案】(1)①碳酸钠 氢氧化钠②过滤③氯化钙
④MgCl2+2NaOH=Mg(OH)2↓+2 NaCl
⑤2NaHCO3![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
(2)BCD
(3)
选择的装置 | 实验现象 | 实验结论 |
AB或AC或ACB | B中不变浑浊或C中不变蓝色或C中不变蓝色且B中不变浑浊 | 样品不含晶体B |
(4)NaCl +AgNO3 ==AgCl↓ + NaNO3
(5)①在上层清液或滤液Y中加可溶性碳酸盐即可 ②BC ③84.8%
【解析】
试题分析:粗盐中含有少量可溶性杂质(MgCl2和CaCl2会和加入的过量的氢氧化钠和碳酸钠反应产生氯化钠,但是二者都是过量的所以溶液A中的溶质有NaCl和碳酸钠 氢氧化钠;操作Ⅱ能够得到固体和液体的分离所以名称为过滤;流程中Na2CO3溶液的作用是除去粗盐中的氯化钙;NaOH溶液与MgCl2反应的化学方程式MgCl2+2NaOH=Mg(OH)2↓+2 NaCl;氯化钠和氨气、二氧化碳反应产生碳酸氢钠,碳酸氢钠固体受热会产生碳酸钠、水、二氧化碳;上述生产流程中可循环使用的是NH3;HCl;CO2;纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀,发生的反应是:NaCl +AgNO3 ==AgCl↓ + NaNO3;判断加入氯化钙溶液是否过量的方法是在上层清液或滤液Y中加可溶性碳酸盐看是否还有沉淀产生;判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加硝酸银溶液或者碳酸钠溶液;设产生10.克的碳酸钙需要碳酸钠的质量为X。
Ca(OH)2 + Na2CO3===2NaOH +CaCO3↓
106 100
X 10.0克
列比例式得:106:X=100:10.0 求得X=10.6克
样品中碳酸钠的质量分数是10.6/12.5克×100%= 84.8%。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】2011年诺贝尔化学奖被授予以色列科学家丹尼尔谢赫曼,以表彰他在发现准晶体方面所作出的突出贡献.准晶体可能具有下列性质,其中属于化学性质的是
A.密度低 B.耐磨损 C.导电性差 D.抗氧化性强
【题目】(6分)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)60℃时,在100 g水里溶解_________g KNO3时,溶液才可达到饱和状态。
(2)下图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
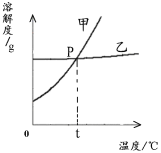
A.10℃~20℃之间 B.20℃~30℃之间
C.30℃~40℃之间 D.40℃~50℃之间
(3)请根据上表或图示总结出一条具有一定规律的结论 。
(4)在0℃时,分别在100 g 水中加入30 g NaCl 和KNO3固体,再加热到60℃时(假设溶剂不损耗),NaCl溶液为______(填“饱和”或“不饱和”)溶液。加热前后,有关两种溶液的说法正确的是_____(填字母序号)。
A.0℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数由小变大
D.加热前后,KNO3溶液中溶质的质量分数不变