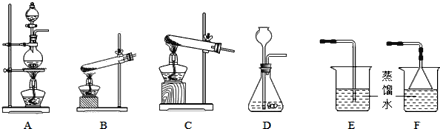
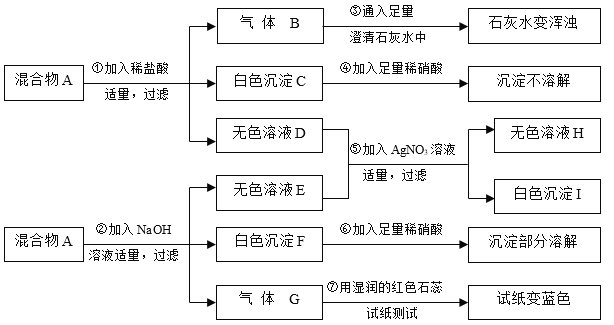
题目内容
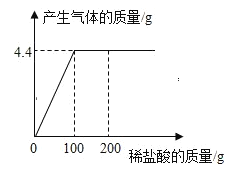
【题目】取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,添加稀盐酸的质量与产生气体质量的关系如图所示,求:
(1)混合物中CaCO3中的质量分数____;
(2)稀盐酸中的溶质质量分数____;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数?____(写出计算过程,计算结果精确到0.1%)
【答案】80% 7.3% 12.6%
【解析】
(1)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,由图可知:至恰好完全反应时,参加反应的稀盐酸的总质量为100g,过程生成二氧化碳的总质量为4.4g。
设碳酸钙的质量为x,稀盐酸中的溶质质量为z,生成氯化钙的质量为y,则
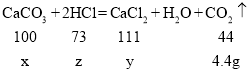
![]()
解得x=10g,z=7.3g,y=11.1g;
混合物中碳酸钙的质量分数为![]() ;
;
(2)稀盐酸中的溶质质量分数为![]() ;
;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为![]() 。
。

练习册系列答案
相关题目