题目内容
【题目】某学习小组的同学欲探究某固体混合物A的成分,已知A中可能含有NH4Cl、CuCl2、MgCl2、BaSO4、CaCO3五种物质中的两种或多种。该学习小组的同学取两份相同的固体混合物A样品按如图所示进行探究实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。
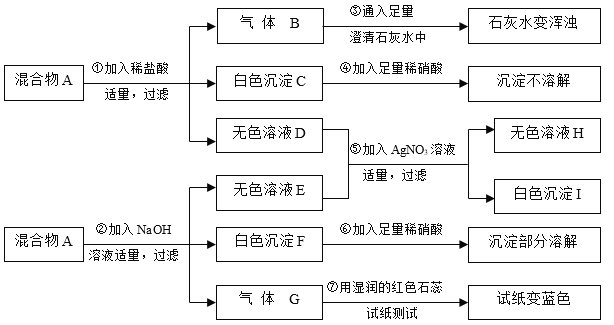
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)步骤①得到的白色沉淀C是_____(填化学式);
(2)步骤②生成气体G的气味为_____;
(3)写出1个步骤⑤一定发生反应的化学方程式_____;
(4)在固体混合物A中,肯定不存在的物质是_____(填化学式);
(5)该学习小组的同学欲进一步探究固体混合物A的组成,设计了如下几个方案,其中合理的是_____(填序号)。
A 以实验过程中所得无色溶液D为研究对象,向其中加入足量澄清石灰水,观察是否产生白色沉淀
B 以实验过程中所得无色溶液E为研究对象,向其中加入足量澄清石灰水,观察是否产生白色沉淀
C 以实验过程中所得无色溶液H为研究对象,向其中加入足量澄清石灰水,观察是否产生白色沉淀
D 以实验过程中所得白色沉淀F为研究对象,向其中加入适量稀硝酸至沉淀不再溶解,过滤,向滤液中加入足量澄清石灰水,观察是否产生白色沉淀
【答案】BaSO4 刺激性气味 NaCl+AgNO3=NaNO3+AgCl↓ CuCl2 ACD
【解析】
根据硫酸钡难溶于水,难溶于酸,碳酸钙难溶于水,溶于酸,氯化铜在溶液中显蓝色,铵态氮肥和碱混合会生成氨气,氨气的水溶液显碱性,氯离子和银离子会生成白色的氯化银沉淀,氯化银沉淀不溶于酸,镁离子和氢氧根离子反应生成氢氧化镁沉淀等知识进行分析。
混合物A中加入稀盐酸生成的气体B能使澄清石灰水变浑浊,所以B是二氧化碳,所以A中含有碳酸钙沉淀C不溶于稀硝酸,所以C是硫酸钡,A中含有硫酸钡;混合物A中加入氢氧化钠生成的气体能使湿润的红色石蕊试纸变蓝色,所以G是氨气,混合物A中含有氯化铵,加入稀硝酸生成的白色沉淀部分溶解,所以A中可能含有氯化镁,一定含有硫酸钡,一定不含氯化铜,无色溶液D和E中加入硝酸银会生成白色沉淀,所以I是氯化银沉淀,所以
(1)步骤①得到的白色沉淀C是BaSO4;
(2)步骤②生成气体G是氨气,气味为刺激性气味;
(3)步骤⑤一定发生的反应是氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3;
(4)在固体混合物A中,肯定不存在的物质是CuCl2;
(5)通过推导可知,不能确定混合物中是否含有氯化镁,所以
A、以实验过程中所得无色溶液D为研究对象,向其中加入足量澄清的石灰水,观察是否产生白色沉淀,可以检验出D中是否含有氯化镁,可以验证,故正确;
B、以实验过程中所得无色溶液E为研究对象,向其中加入足量澄清的石灰水,观察是否产生白色沉淀,可以检验出E中是否含有氯化镁,可以验证,故正确;既使存在氯化镁,会与加入的氢氧化钠反应进入沉淀F,不会进入溶液E,以无色溶液E为研究对象没有意义,故错误;
C、以实验过程中所得无色溶液H为研究对象,向其中加入足量澄清石灰水,观察是否产生白色沉淀,可以检验出H中是否含有氯化镁,可以验证,故正确;
D、以实验过程中所得白色沉定F为研究对象,向其中加入适量稀硝酸至沉淀不再溶解,硝酸会将碳酸钙溶解,生成硝酸钙,硝酸钙不会与氢氧化钙反应,过滤,向滤液中加入足量澄清石灰水,观察是否产生白色沉淀,可以检验氯化镁的存在,故正确。
故选:ACD。
故答案为:(1)BaSO4;
(2)刺激性气味;
(3)NaCl+AgNO3=AgCl↓+NaNO3;
(4)CuCl2;
(5)ACD。