题目内容
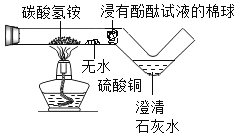
【题目】实验室中用一氧化碳还原纯净的Fe2O3粉末。

反应后装置中玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小军同学提出了质疑,于是同学们提出查阅资料,寻求真理。
(查阅资料)一氧化碳还原Fe2O3的固体产物的成分与反应温度、时间有关,产物可能是Fe3O4、FeO、Fe
几种物质的性质
物质性质 | Fe | Fe2O3 | FeO | Fe3O4 |
颜色 | 黑色 | 红色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
已知反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,FeCl3溶液呈棕黄色
(实验1)(1)该小组同学将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引,则该黑色粉末中不可能含有Fe2O3和_________(填化学式)。
黑色固体粉末的成分是什么?
猜想Ⅰ:全部为Fe
猜想Ⅱ:全部为Fe3O4
猜想Ⅲ:______________(填化学式)
(2)实验:将黑色粉末加入到足量的稀盐酸中,全部溶解,观察现象:
①有无色气体产生,
②溶液呈棕黄色 。
由上述实验现象,得出上述猜想________正确。
(评价与反思)(3)装置中澄清石灰水的作用是__________;若撤出装置中点燃的酒精灯可能造成的后果_______。
(实验2)采用实验1后的剩余物可制备三氯化铁,三氯化铁(FeCl3)可用于金属蚀刻等。
(查阅资料)①通入Cl2可将FeCl2溶液转化成FeCl3溶液。
②FeCl3蚀刻铜反应原理:废铜电路板上的铜与FeCl3溶液反应生成FeCl2和CuCl2
③FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能。
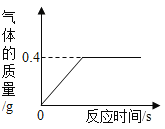
将实验1后的剩余物进行分步实验,操作过程中氯化铁的质量变化如图:
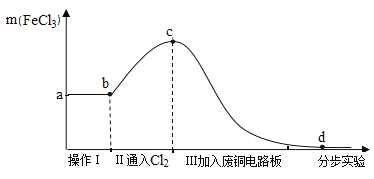
(4)操作Ⅰ可除去固体残渣,该操作的名称是_________。
(5)通过操作Ⅱ,氯化铁的质量增加的原因是__________。
(6)通过操作Ⅲ,得到d溶液,检验d溶液中是否还含有氯化铁的方法是_______。
【答案】FeO Fe和Fe3O4 Ⅲ 检验有二氧化碳生成 一氧化碳会污染空气 过滤 Cl2可将FeCl2溶液转化成FeCl3溶液 取少量试液,滴入KSCN溶液,若变红色,则还有FeCl3
【解析】
(1)该小组同学将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引,则该黑色粉末中不可能含有Fe2O3和FeO,因为只有铁和四氧化三铁才能被磁铁吸引;
猜想Ⅰ:全部为Fe
猜想Ⅱ:全部为Fe3O4
猜想Ⅲ:Fe和Fe3O4的混合物
(2)实验:将黑色粉末加入到足量的稀盐酸中,全部溶解,观察现象:
①有无色气体产生,说明铁与稀盐酸反应产生氢气,
②溶液呈棕黄色,说明四氧化三铁与稀盐酸反应产生氯化铁溶液;
由上述实验现象,得出上述猜想Ⅲ正确。
(3)二氧化碳能使澄清的石灰水变浑浊,装置中澄清石灰水的作用是:检验有二氧化碳生成;一氧化碳有毒,若撤出装置中点燃的酒精灯(属于尾气处理装置)可能造成的后果:未反应的一氧化碳会污染空气;
(4)操作Ⅰ分离滤渣和滤液,可除去固体残渣,该操作的名称是:过滤。
(5)通过操作Ⅱ,氯化铁的质量增加的原因是:通入Cl2可将FeCl2溶液转化成FeCl3溶液;
(6)操作Ⅲ,加入废铜电路板,铜与氯化铁反应生成氯化铜和氯化亚铁,得到d溶液,因为:FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能;检验d溶液中是否还含有氯化铁的方法是:少量试液,滴入KSCN溶液,若变红色,则还有FeCl3。

【题目】(8分)目前市场上的补钙药剂很多,下图是某品牌补钙药品的部分说明书.

为测定其含量是否达标,某兴趣小组的同学取10片钙片研碎后放于烧杯中,将100g稀盐酸分五次加入到烧杯中,并不断搅拌,称量,将得到的有关数据记录如下(钙片中其它成分不与稀盐酸反应):
加入稀盐酸的质量/g | 0 | 20 | 40 | 60 | 80 | 100 |
烧杯中剩余物质质量/g | 10 | 29.12 | 48.24 | 67.36 | 86.48 | 106.48 |
请你根据题给信息和表中数据,回答下列问题:
(1)实验过程中将钙片研碎的目的是: .
(2)完全反应后,产生二氧化碳的质量为 g.
(3)试通过计算说明,该品牌钙片含量是否达标.(写出计算过程)
(4)如果按用量服用,服用者每天通过该补钙剂摄入钙元素的质量为 g.