题目内容
【题目】“珍惜、节约和爱护水”是每个公民应尽的义务和责任。试回答
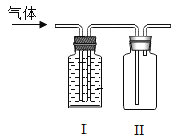
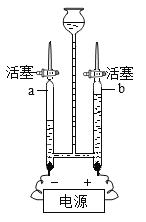
(1)用如图所示装置进行电解水的实验,a、b两玻璃管中收集到的气体体积比为________,反应的化方程式为______。
(2)饮用硬度过大的水不利于人体键康,在生活中可用________区分硬水和软水;
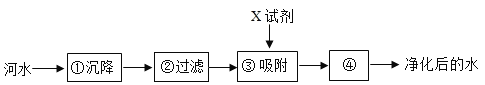
(3)如图是自来水厂净化水的主要步骤。其中X试剂可以是____________步骤④的作用是_______
(4)请列举一例生活中节约用水的具体做法______。
【答案】2:1 2H2O![]() 2H2↑+O2↑ 肥皂水 活性炭 消毒杀菌 用洗菜水浇花
2H2↑+O2↑ 肥皂水 活性炭 消毒杀菌 用洗菜水浇花
【解析】
(1)电解水的实验中,正极产氧气,负极产生氢气,a、b两玻璃管中收集到的氢气与氧气的气体体积比为2:1,水通电产生氢气和氧气反应的化方程式为:2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。
(2)饮用硬度过大的水不利于人体键康,在生活中可用肥皂水区分硬水和软水,将其分别与软水和硬水混合后搅拌,浮渣多,泡沫少的是硬水,反之是软水;
(3)如图是自来水厂净化水的主要步骤。其中X试剂可以是活性炭,可以吸附色素和异味;步骤④的作用是:杀菌和消毒,以便达到饮用水标准;
(4)请列举一例生活中节约用水的具体做法:洗菜水浇花。

【题目】实验室中用一氧化碳还原纯净的Fe2O3粉末。

反应后装置中玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小军同学提出了质疑,于是同学们提出查阅资料,寻求真理。
(查阅资料)一氧化碳还原Fe2O3的固体产物的成分与反应温度、时间有关,产物可能是Fe3O4、FeO、Fe
几种物质的性质
物质性质 | Fe | Fe2O3 | FeO | Fe3O4 |
颜色 | 黑色 | 红色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
已知反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,FeCl3溶液呈棕黄色
(实验1)(1)该小组同学将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引,则该黑色粉末中不可能含有Fe2O3和_________(填化学式)。
黑色固体粉末的成分是什么?
猜想Ⅰ:全部为Fe
猜想Ⅱ:全部为Fe3O4
猜想Ⅲ:______________(填化学式)
(2)实验:将黑色粉末加入到足量的稀盐酸中,全部溶解,观察现象:
①有无色气体产生,
②溶液呈棕黄色 。
由上述实验现象,得出上述猜想________正确。
(评价与反思)(3)装置中澄清石灰水的作用是__________;若撤出装置中点燃的酒精灯可能造成的后果_______。
(实验2)采用实验1后的剩余物可制备三氯化铁,三氯化铁(FeCl3)可用于金属蚀刻等。
(查阅资料)①通入Cl2可将FeCl2溶液转化成FeCl3溶液。
②FeCl3蚀刻铜反应原理:废铜电路板上的铜与FeCl3溶液反应生成FeCl2和CuCl2
③FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能。
将实验1后的剩余物进行分步实验,操作过程中氯化铁的质量变化如图:
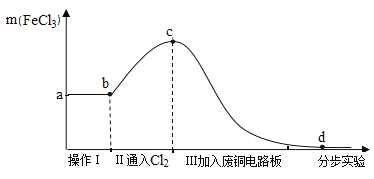
(4)操作Ⅰ可除去固体残渣,该操作的名称是_________。
(5)通过操作Ⅱ,氯化铁的质量增加的原因是__________。
(6)通过操作Ⅲ,得到d溶液,检验d溶液中是否还含有氯化铁的方法是_______。