题目内容
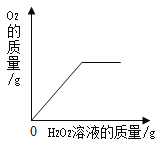
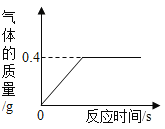
【题目】有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。试求:
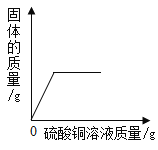
(1)样品中金属铜的质量是______g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
(3)求反应后所得溶液的溶质质量分数。(保留小数点后一位)
【答案】19.5 19.6% 28.6%
【解析】
解:(1)由图像可知产生0.4g氢气;
设:参加反应锌的质量为x,所用硫酸的质量为y,生成的硫酸锌的质量为z
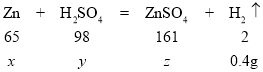
![]()
x=13.0g
![]()
y=19.6g
![]()
z=32.2g
样品中金属铜的质量=32.5g-13.0g=19.5g;
(2)所用稀硫酸的溶质质量分数=![]() ;
;
(3)所得硫酸锌溶液的溶质质量分数=![]() 。
。

 小题狂做系列答案
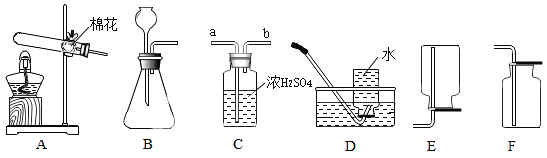
小题狂做系列答案【题目】实验室中用一氧化碳还原纯净的Fe2O3粉末。

反应后装置中玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小军同学提出了质疑,于是同学们提出查阅资料,寻求真理。
(查阅资料)一氧化碳还原Fe2O3的固体产物的成分与反应温度、时间有关,产物可能是Fe3O4、FeO、Fe
几种物质的性质
物质性质 | Fe | Fe2O3 | FeO | Fe3O4 |
颜色 | 黑色 | 红色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
已知反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,FeCl3溶液呈棕黄色
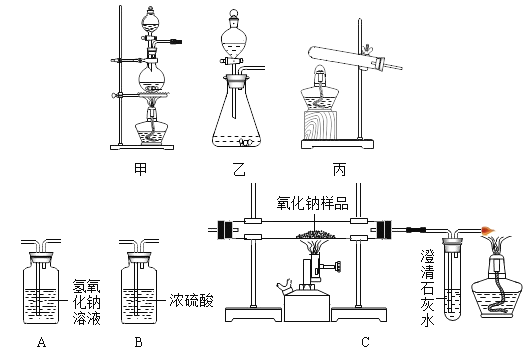
(实验1)(1)该小组同学将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引,则该黑色粉末中不可能含有Fe2O3和_________(填化学式)。
黑色固体粉末的成分是什么?
猜想Ⅰ:全部为Fe
猜想Ⅱ:全部为Fe3O4
猜想Ⅲ:______________(填化学式)
(2)实验:将黑色粉末加入到足量的稀盐酸中,全部溶解,观察现象:
①有无色气体产生,
②溶液呈棕黄色 。
由上述实验现象,得出上述猜想________正确。
(评价与反思)(3)装置中澄清石灰水的作用是__________;若撤出装置中点燃的酒精灯可能造成的后果_______。
(实验2)采用实验1后的剩余物可制备三氯化铁,三氯化铁(FeCl3)可用于金属蚀刻等。
(查阅资料)①通入Cl2可将FeCl2溶液转化成FeCl3溶液。
②FeCl3蚀刻铜反应原理:废铜电路板上的铜与FeCl3溶液反应生成FeCl2和CuCl2
③FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能。
将实验1后的剩余物进行分步实验,操作过程中氯化铁的质量变化如图:
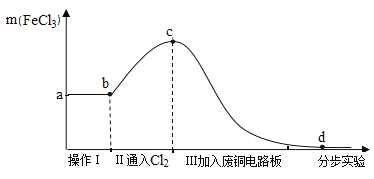
(4)操作Ⅰ可除去固体残渣,该操作的名称是_________。
(5)通过操作Ⅱ,氯化铁的质量增加的原因是__________。
(6)通过操作Ⅲ,得到d溶液,检验d溶液中是否还含有氯化铁的方法是_______。
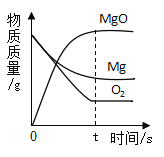
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
A.向一定质量的二氧化 锰中加入过氧化氢溶液 | B. 向等 质量的镁 粉和 铝粉中分别加入等浓度 的稀盐酸 | C. 镁在氧气中燃烧 | D. 向一定量铁粉和铜粉混 合物中加入硫酸铜溶液 |
A.AB.BC.CD.D