题目内容
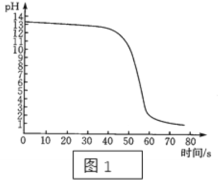
【题目】如图是甲、乙两种固体物质的溶解度曲线,下列说法错误的是( )
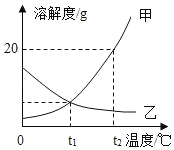
A. 甲中含有少量的乙可以采用降温结晶的方法提纯甲
B. 将t1℃甲、乙的饱和溶液升温至t2℃时,乙溶质质量分数变小
C. t2℃时,甲饱和溶液中溶质的质量分数比乙饱和溶液大
D. t2℃时,等质量的甲、乙两种物质配饱和溶液,甲溶液质量大
【答案】D
【解析】
A、甲中含有少量的乙可以采用降温结晶的方法提纯甲正确,因为甲固体物质的溶解度是随温度升高而增大,而乙的溶解度随温度的升高而减少,不符合题意;
B、乙的溶解度随温度的升高而减少,将t1℃甲、乙的饱和溶液升温至t2℃时,乙溶质质量分数变小,因为乙有固体析出,不符合题意;
C、t2℃时,甲饱和溶液中溶质的质量分数比乙饱和溶液大,因为该温度下甲的溶解度大于乙,不符合题意;
D、t2℃时,甲的溶解度大于乙,等质量的甲、乙两种物质配饱和溶液,甲所需溶剂质量小于乙,故乙溶液的质量大,符合题意。故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:
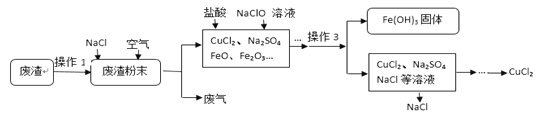
(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。