题目内容
【题目】中和反应在工农业生产和生活中有有泛的应用。某学生课外兴趣小组对中和反应进行研究。
(实验一)对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如下实验来进行。
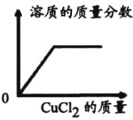
将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反府过程中溶液的pH、温度进行实验测定,得到的曲线如图、如图所示中。
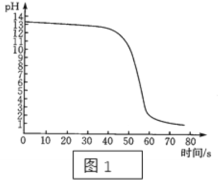

如图、如图均能证明中和反应发生了,如图能证明中和反应的判断依据是________________________________。由如图还能得出的其他结论是____________________________________。
(实验二)取少量难溶的氢氧化镁置于试管中加水振荡,得到浑浊液,再加入稀盐酸,若观察到现象_____,就可说明反应已经发生。该反应的化学方程式是____________________________________。
(实验反思)在敞口久置的氢氧化钠溶液中加入盐酸后,意外发现有气泡产生,同学们认为产生意外现象是因为______________________________而变质,变质后的物质和盐酸反应生成了___________气体。
(实验三)用白色无水硫酸铜粉末证明酸与碱之间能发生中和反应。

(1)在试管①和②中加入等质量的无水硫酸铜粉末,并在试管②里加入一些固体氢氧化钠和无水醋酸与无水硫酸铜粉末混合,段时间后试管②中无水硫酸铜粉末先变蓝,说明有水生成,从而证明中和反应发生了。
(2)小艺认为上述对照试验不能证明酸与碱发生了中和反应,小艺的理由是________________________________________________.你认为应怎样改进试验?______
(实验四)利用如图所示的原理来证明酸与碱可以发生中和反应。
(1)在盛有10mL浓硫酸的烧杯中倒入5mL氢氧化钠溶液,溶液温度迅速上升,由此证明硫酸与氢氧化钠发生了中和反应。小涵认为该实验不能证明硫酸与氢氧化钠发生了反应,小涵的理由是___________________.
(2)该实验可能造成的危害是_____________________________________________.
【答案】pH由大于7逐渐变为等于、小于7(或溶液由碱性逐渐变为酸性。只答pH减小或pH变化不得分) 中和反应放热 液体变澄清(或浑浊消失或沉淀消失) Mg(OH)2+2HCl=MgCl2+2H2O 氢氧化钠与空气中二氧化碳反应 CO2 氢氧化钠固体易吸水而潮解 在密闭容器中进行实验 浓硫酸溶于水放热 局部温度过高造成酸液飞溅(或液滴溅出)
【解析】
实验一:
图1能证明中和反应的判断依据是溶液pH由大于7变成小于7,说明氢氧化钠完全反应;
由图2还能得出的其他结论是中和反应放热。
实验二:
取少量难溶的氢氧化镁置于试管中加水振荡,得到浑浊液,再加入稀盐酸,若观察到浑浊液变澄清,即可证明反应发生,因为氢氧化镁和盐酸反应生成氯化镁和水,该反应的化学方程式是:Mg(OH)2+2HCl=MgCl2+2H2O。
实验反思:
在敞口久置的氢氧化钠溶液中加入盐酸后,意外发现有气泡产生,产生意外现象是因为氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。
实验三:
(2)硫酸铜吸收了空气中的水蒸气也会产生同样的现象;改进方法:两支试管中充满氮气后密封,再观察现象。
实验四:
(1)浓硫酸溶于水放出大量的热,也会使温度上升。(2)该实验可能造成的危害是浓硫酸等液体飞溅,发生安全事故。

【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成。为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性,经过思考设计并进行了以下实验:
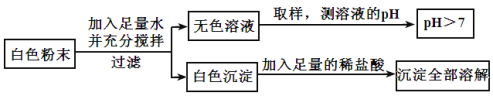
(1)白色粉末中一定不含_____________;可能含有____________。
(2)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(作出猜想)猜想Ⅰ:Na2CO3
猜想Ⅱ:NaOH
猜想Ⅲ:Na2CO3和NaOH
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
① 取无色滤液少许于试管中,滴加过量的BaCl2溶液 | ________ | 猜想Ⅱ不成立 |
② 在①反应后的试管中滴加________ | 溶液变为红色 | 猜想Ⅲ成立 |
(得出结论)白色粉末的成分是________________。