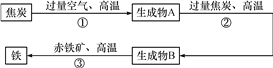
题目内容
【题目】若6.5g锌与100g稀硫酸恰好完全反应。
(1)在100g稀硫酸中,溶质的化学式为______,其质量为___g,溶剂的化学式为____,其质量为_____g;
(2)完全反应后,所得溶液的质量为____g,其中溶质的化学式为______,其质量为____g。
【答案】 H2SO4 9.8 H2O 90.2 106.3 ZnSO4 16.1
【解析】锌与稀硫酸反应生成硫酸锌和氢气,并且是恰好完全反应。
Zn+H2SO4=ZnSO4+H2↑。
65 98 161 2
6.5g x y z
![]() =
=![]() ,x=9.8g。
,x=9.8g。
![]() =
=![]() ,y=16.1g。
,y=16.1g。
![]() =
=![]() ,z=0.2g。
,z=0.2g。
在100g稀硫酸中,溶质的化学式为H2SO4,其质量为9.8g,溶剂的化学式为H2O ,其质量为∶ 100g-9.8g=90.2g。(2)根据质量守恒定律,完全反应后,所得溶液的质量为∶6.5g+100g-0.2g=106.3g,其中溶质的化学式为ZnSO4,其质量为16.1g。
点睛∶仔细认真审题,灵活应用质量守恒定律,正确书写化学方程式并能根据化学方程式进行简单的计算是的学生的基本要求。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目