题目内容
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:
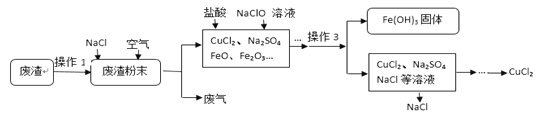
(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。
【答案】(1)增大接触面积,使反应充分;(2)CuS+2NaCl+2O2![]() CuCl2+Na2SO4 (3)过滤 引流 3.2~4.7 (4)氯化钠
CuCl2+Na2SO4 (3)过滤 引流 3.2~4.7 (4)氯化钠
【解析】
试题分析:(1)操作1把废渣粉碎的目的增大接触面积,使反应充分;(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,该反应的化学方程式为CuS+2NaCl+2O2![]() CuCl2+Na2SO4;(3)操作3后固液分离,故操作的名称为过滤,玻璃棒的作用是引流;根据题中提供的信息,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,三价铁离子要沉淀完全,铜离子不能沉淀,故 调节溶液的pH到3.2~4.7比较合适;(4)流程图中能循环利用的物质是氯化钠和水。
CuCl2+Na2SO4;(3)操作3后固液分离,故操作的名称为过滤,玻璃棒的作用是引流;根据题中提供的信息,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,三价铁离子要沉淀完全,铜离子不能沉淀,故 调节溶液的pH到3.2~4.7比较合适;(4)流程图中能循环利用的物质是氯化钠和水。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目