题目内容
【题目】某氢氧化钠样品中混有氯化钠杂质,为测定样品中杂质的质量分数,称取5g样品,加入27g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,刚好用去10%的稀盐酸36.5g。计算:
(1)样品中氯化钠的质量分数_____________。
(2)反应后所得溶液中溶质的质量分数___________。
【答案】20% 10%
【解析】
(1)假设样品中氯化钠的质量分数为x则根据氢氧化钠和盐酸反应的关系得:
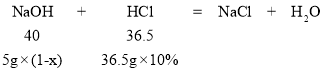
40×36.5g×10% = 36.5×5g(1-x) 解得x=20%
(2)根据元素守恒溶质的质量为氯元素质量和钠元素质量
钠元素质量=样品中氢氧化钠的钠元素+氯化钠的钠元素
氯元素只质量=样品中氯化钠的氯元素+盐酸中氯元素质量
样品中氯化钠的质量为5g×20% = 1g
样品中氢氧化钠中的钠元素=5g×0.8×23÷40=2.3g
盐酸中氯元素=10%×36.5g×35.5÷36.5=3.55g
溶质的总质量=1g+2.3g+3.55g=6.85g
溶液的总质量=5g+27g+36.5g=68.5g
溶质的质量分数=6.85g÷68.5g×100% = 10%

练习册系列答案
相关题目