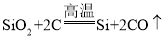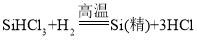题目内容
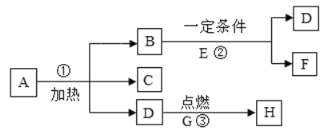
【题目】A-I是初中常见的纯净物,它们的转化关系如下图,一些反应条件已略去,其中A在常温下是无色液体,可作溶剂,B为单质,E为黑色固体, H为蓝色沉淀。
根据以上信息回答下列问题:

(1)写出E的化学式:________________。
(2)写出反应①的化学方程式________________。
(3)写出反应②的化学方程式________________。
(4)反应③属于________________反应(填基本反应类型)。
【答案】CuO ![]() 或
或
![]() (其他合理答案均可得分) 复分解
(其他合理答案均可得分) 复分解
【解析】
A-I是初中常见的纯净物,E为黑色固体,且E可与稀硫酸反应生成D和G,G可与F反应生成H和I,H为蓝色沉淀,可推出H为氢氧化铜,那么G为硫酸铜,E为氧化铜,D为水,A在常温下是无色液体,可做溶剂,且A可与氧气反应生成C和水,可推出A为乙醇,C为二氧化碳,B为单质,氧化铜可转化为B和二氧化碳,可推出B为铜,水可转化为F,F可与硫酸铜反应生成氢氧化铜和I,可推出F为氢氧化钙,I为硫酸钙。
(1)E为氧化铜,化学式为:CuO;
(2)反应①为氧化铜转化为铜和二氧化碳,氧化铜可与一氧化碳在加热的条件下反应生成铜和二氧化碳,该反应的化学方程式为:![]() ,氧化铜也可和碳在高温下反应生成铜和二氧化碳,该反应的化学方程式为:
,氧化铜也可和碳在高温下反应生成铜和二氧化碳,该反应的化学方程式为: ;
;
(3)反应②为水转化为氢氧化钙,水可与氧化钙反应生成氢氧化钙,该反应的化学方程式为:![]() ;
;
(4)反应③为氢氧化钙和硫酸铜反应生成硫酸钙和氢氧化铜沉淀,该反应的化学方程式为:![]() ,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应。
,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应。

 春雨教育同步作文系列答案
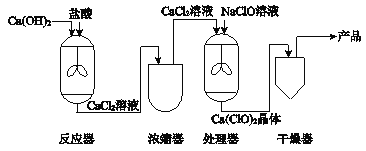
春雨教育同步作文系列答案【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
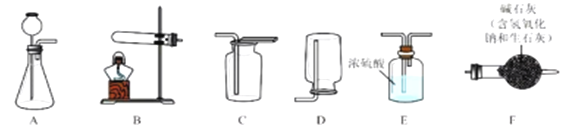
I.气体制备
(1)二氧化碳气体制备
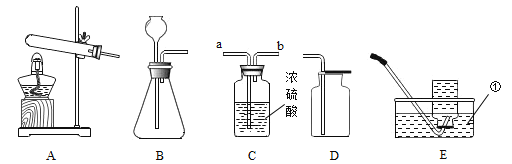
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。