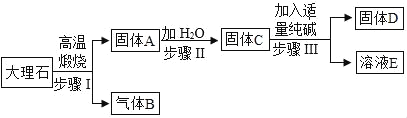
题目内容
【题目】已知NaHCO3受热分解生成Na2CO3,![]() 。把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克。下列说法正确的是( )
。把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克。下列说法正确的是( )
A. 反应生成的CO2质量为4.4克B. 样品中Na2CO3的质量分数为30%
C. 样品中NaHCO3的质量为8.6克D. 样品中钠元素的质量分数为43.3%
【答案】B
【解析】
碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,反应前后的质量差即为反应生成的水和二氧化碳的质量。
设碳酸氢钠质量为x、反应生成的碳酸钠y、二氧化碳的质量为z
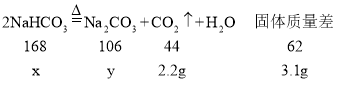
![]()
![]()
![]()
![]()
A、反应生成的CO2质量为2.2克,故A不正确;
B、样品中Na2CO3的质量分数为![]() ,故B正确;
,故B正确;
C、样品中NaHCO3的质量为8.4克,故C不正确;
D、样品中钠元素的质量为![]() ,样品中钠元素的质量分数为
,样品中钠元素的质量分数为![]() ,故D不正确。故选B。
,故D不正确。故选B。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】金属钴和锰及它们的化合物用途广泛,请根据题目回答。
(1)部分锰的化合物的颜色及溶解性见下表:
物质 | KMnO4 | MnO2 | MnO | Mn3O4 | MnSO4 | MnCO3 |
颜色 | 黑色 | 黑色 | 绿色 | 黑色 | 白色 | 白色 |
溶解性 | 易溶 | 难溶 | 难溶 | 难溶 | 易溶 | 难溶 |
①上述固体中,显绿色的是_____。
②若向 MnSO4 溶液的试管中滴入 Na2CO3 溶液,化学方程式是_____。
③下图表示上述反应前后溶液中存在的主要离子,写出以下图形代表的离子:______、______
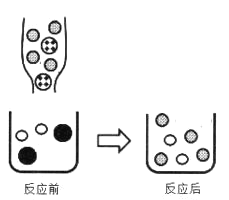
![]()
(2)已知 Co2O3 固体黑色粉末,CoSO4 溶液是粉红色的。向盛有 Co2O3 的试管里加入稀硫酸, 发生反应 2Co2O3+4H2SO4===4CoSO4+O2↑+4H2O。预设观察到的现象是______
【题目】密闭容器中甲、乙、丙、丁四种物质在一定条件下发生化学反应,不同时刻的质量如表所示。
甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g | |
反应前 | 64 | 10 | 1 | 16 |
t时刻 | 32 | a | b | c |
反应后 | 0 | 42 | d | 48 |
已知甲的相对分子质量为丁的2倍,下列有关说法错误的是( )
A. a为32
B. 该反应属于分解反应
C. 丙可能是催化剂
D. 该反应的化学方程式中甲与丁的化学计量数之比为1:1
【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
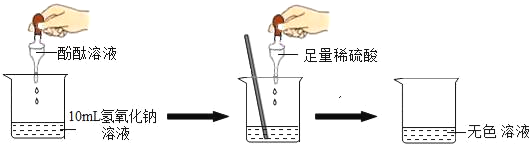
当滴入几滴酚酞试液后,溶液由无色变为_____色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为:_____。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | _____ | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | _____ | 稀硫酸过量 |
上述设计的实验方案中,正确的是_____(填“方案一”或“方案二”)。另外一个实验方案错误的原因是_____。若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是_____,实验现象及结论是_____。