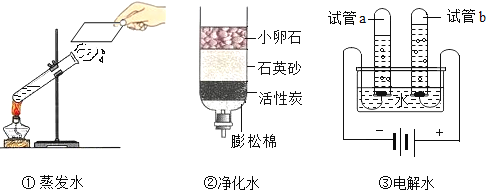
题目内容
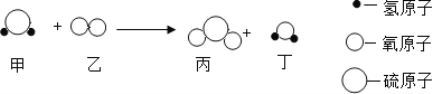
【题目】某实验小组欲探究氧化铜能否起到类似MnO2的催化作用,进行了三组对照实验:分别按下表中的质量混合好三份固体,在相同条件下加热,将生成的气体通入如图的装置中,并与进行比较。实验时间均以生成50 mL气体为准,其他可能影响实验的因素均忽略。
编号 | KCLO3质量 | 其他物质质量 | 待测数据 |
1 | 2.0g | ∕ | |
2 | 2.0g | MnO2 0.5g | |
3 | 2.0g | CuO a g |
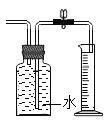
回答下列问题:
(1)实验中氧化铜的质量应称取_______g;
(2)表格中的“待测数据”是指_______;
(3)为了较准确地测量气体体积,视线要_______;
实验步骤 | 设计这一步骤的目的 |
A 实验表明,加入CuO后产生O2的速率比未加入时快得多 | 证明CuO能加快KCLO3的分解 |
B 过滤,洗涤,烘干,得到CuO固体粉末,再称量。 | _________________________ |
C |
(4)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验:______
【答案】0.5 产生50mL的氧气所用时间 与凹液面最低处水平 证明氧化铜的质量在化学反应前后不改变 将B中得到的固体粉末与2.0g氯酸钾混合,加热产生氧气的速率比未加入时快得多;证明氧化铜的化学性质在化学反应前后未改变
【解析】
(1)实验中氧化铜的质量应称取0.5g,应该与二氧化锰质量相等;
(2)表格中的“待测数据”是指:产生50mL的氧气所用时间;
(3)为了较准确地测量气体体积,视线要与量筒凹液面最低处水平;如果要进一步探究CuO在反应中是否起到催化作用,需要证明氧化铜的质量在化学反应前后不改变;
(4)将B中得到的固体粉末与2.0g氯酸钾混合,加热产生氧气的速率比未加入时快得多;证明氧化铜的化学性质在化学反应前后未改变。

 阅读快车系列答案
阅读快车系列答案【题目】控制变量,设计对比实验是实验探究的重要方法。
实验一:区分硬水和软水。
| 本实验条件除了要控制所取硬、软水的体积相同外,还必须要控制___________相同。 |
实验二:探究人体吸入的空气与呼出的气体有什么不同。
| 将燃着的小木条分别插入空气样品和呼出气体的样品中,对比观察到的现象,可以得出的结论是___________。 |
实验三:探究决定氯化铁溶液颜色的粒子。
| 氯化铁溶液呈黄色。为了探究溶液中的哪种粒子使溶液呈黄色,小艳同学分析溶液中存在的粒子,选择了一种试剂作对比,确定了决定氯化铁溶液颜色粒子,用作对比的试剂可以是___________溶液。 |
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
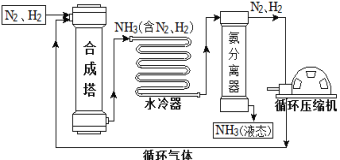
(1)合成塔中的反应属于___(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于___(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是___。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105Pa时,欲将NH3与N2、H2分离,最好将温度控制在___℃之间。
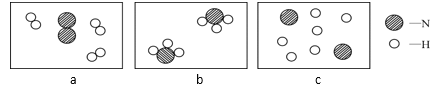
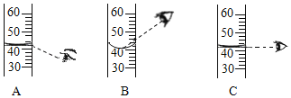
(5)1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2 →2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为__(用字母表示)。