题目内容
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
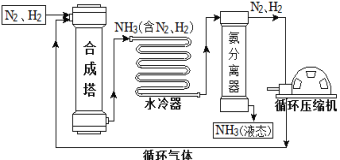
(1)合成塔中的反应属于___(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于___(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是___。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105Pa时,欲将NH3与N2、H2分离,最好将温度控制在___℃之间。
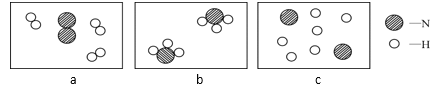
(5)1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2 →2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为__(用字母表示)。
【答案】化合反应 混合物 N2、H2 -195.8℃到-33.35℃ acb
【解析】
(1)根据题目给出的流程图和信息:氮气和氢气在高温、高压、催化剂条件下生成氨气,反应的化学方程式为N2+3H2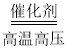 2NH3符合”多变一“的特征,属于化合反应;
2NH3符合”多变一“的特征,属于化合反应;
(2)生产过程中从合成塔中输出的气体属于混合物,因为氨气中混有氮气氢气等;
(3)氮气和氢气既是原料又是产物,可以循环利用;
(4)根据表中物质的沸点判断,要将产物NH3与N2、H2分离开来,适宜的方法是控制温度:-33.35℃>温度>-195.8℃;
(5)合成氨的微观过程是氢气分子氮气分子分解成单个的原子,然后氮原子和氢原子再组合成氨气分子,观察图示,故顺序为acb。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组欲探究氧化铜能否起到类似MnO2的催化作用,进行了三组对照实验:分别按下表中的质量混合好三份固体,在相同条件下加热,将生成的气体通入如图的装置中,并与进行比较。实验时间均以生成50 mL气体为准,其他可能影响实验的因素均忽略。
编号 | KCLO3质量 | 其他物质质量 | 待测数据 |
1 | 2.0g | ∕ | |
2 | 2.0g | MnO2 0.5g | |
3 | 2.0g | CuO a g |
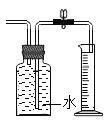
回答下列问题:
(1)实验中氧化铜的质量应称取_______g;
(2)表格中的“待测数据”是指_______;
(3)为了较准确地测量气体体积,视线要_______;
实验步骤 | 设计这一步骤的目的 |
A 实验表明,加入CuO后产生O2的速率比未加入时快得多 | 证明CuO能加快KCLO3的分解 |
B 过滤,洗涤,烘干,得到CuO固体粉末,再称量。 | _________________________ |
C |
(4)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验:______