题目内容
在学习酸和碱的知识时,王老师将几块氢氧化钠放在表面皿中,放置在教室的橱柜里,过了几天,表面皿中块状固体出现了许多白色粉末,同学们就此展开探究.
(1)小杰猜想粉末是碳酸钠,原因的化学方程式是 .
(2)小鑫用两种不同类别的物质检验出了碳酸钠的存在,他选用的试剂是 和 .
(3)小源取少量固体样品,配成溶液加入无色酚酞来检验,发现溶液变红色,说明溶液中一定存在的物质是 (填化学式)
(4)喜欢动手的壮壮同学设计出了实验装置如图所示.实验时向试管里的水中加入固体氢氧化钠后,原来U形管内两臂在同一水平面上的红墨水,右面液面将 .(填“上升”或“下降”)原因是 .如果要观察到相反的现象,可以向水中加入 .

(5)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,计算所得溶液中溶质的质量分数?
(1)小杰猜想粉末是碳酸钠,原因的化学方程式是 .
(2)小鑫用两种不同类别的物质检验出了碳酸钠的存在,他选用的试剂是 和 .
(3)小源取少量固体样品,配成溶液加入无色酚酞来检验,发现溶液变红色,说明溶液中一定存在的物质是 (填化学式)
(4)喜欢动手的壮壮同学设计出了实验装置如图所示.实验时向试管里的水中加入固体氢氧化钠后,原来U形管内两臂在同一水平面上的红墨水,右面液面将 .(填“上升”或“下降”)原因是 .如果要观察到相反的现象,可以向水中加入 .

(5)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,计算所得溶液中溶质的质量分数?
(1)2NaOH+CO2=Na2CO3+H2O;(2)稀盐酸,澄清的石灰水;(3)NaOH;(4)上升,氢氧化钠固体溶于水会放出大量的热,硝酸铵;(5)11.7%.
试题分析:(1)氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,故可以猜想白色粉末是碳酸钠,故填:2NaOH+CO2=Na2CO3+H2O;(2)碳酸钠能与盐酸反应生成二氧化碳气体,而氢氧化钠与盐酸反应没有现象,故可以使用盐酸检验碳酸钠的存在;碳酸钠能与氢氧化钙溶液反应生成碳酸钙白色沉淀,而氢氧化钠与氢氧化钙不反应,故可以使用氢氧化钙溶液检验碳酸钠的存在,故填:稀盐酸,澄清的石灰水(3)取少量固体样品,配成溶液加入无色酚酞来检验,发现溶液变红色,说明溶液呈碱性,故一定存在氢氧化钠,故填:NaOH;(4)由于氢氧化钠固体溶于水会放出大量的热,会导致瓶内的温度升高,分子间的间隔增大,压强变大,故右边液面会上升,如果要使左边液面上升,则需要使瓶内的压强变小,此时加入的物质应该是溶于水吸热,导致瓶内的温度降低,此物质可以是硝酸铵,故填:上升,氢氧化钠固体溶于水会放出大量的热,硝酸铵;
(5)设生成氯化钠的质量我x
NaOH+HCl=NaCl+H2O
36.5 58.5
73g×20% x
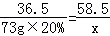 x=23.4g
x=23.4g所得溶液中的溶质质量分数为:
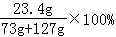 =11.7%
=11.7%答:所得溶液中溶质的质量分数为11.7%.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目



