题目内容
工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下:

(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是 t.
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)

(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是 t.
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)
9;8.04t
试题分析:(1)碳酸钙的质量=12t×75%=9t;
(2)设生成氧化钙的质量为x.则
CaCO3
 CaO+CO2↑
CaO+CO2↑100 56
9t x
 =
=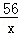 ,
,解之得:x=5.04t
因为生成的生石灰中含有未参与反应的杂质,杂质的质量=12t×(1﹣75%)=3t
所以最终可以生产生石灰的质量=5.04t+3t=8.04t
答:可生产生石灰8.04t.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目




 4FeO+CO2↑.试计算应向160gFe2O3粉末中加入木炭粉的质量.
4FeO+CO2↑.试计算应向160gFe2O3粉末中加入木炭粉的质量. 2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。 