题目内容
某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量。他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如下表所示:
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为 。(2分)
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)(6分)
(3)请分析该方法测定结果可能会偏大的原因有 (写出一点即可)(2分)
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为 。(2分)
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)(6分)
(3)请分析该方法测定结果可能会偏大的原因有 (写出一点即可)(2分)
(1)3.2g (2)6.8% (3)该反应放热使水分蒸发。
试题分析:化学反应应遵守质量守恒定律,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,由于反应后有气体生成没有加进去,,所以随着反应的进行,质量会越来越少,直至最终质量不变,说明反应结束,故由质量守恒定律可知,生成氧气质量=335.70g-332.50g=3.2g,再根据化学反应方程式:2H2O2
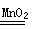 2H2O+ O2↑中过氧化氢的质量与氧气的质量关系,即可算出过氧化氢溶液中溶质的质量,再根据溶质的质量分数的表达式,便可求出结果
2H2O+ O2↑中过氧化氢的质量与氧气的质量关系,即可算出过氧化氢溶液中溶质的质量,再根据溶质的质量分数的表达式,便可求出结果解:(1)根据质量守恒定律,生成氧气质量=335.70g-332.50g=3.2g
(2)设反应前溶液中含溶质过氧化氢质量为
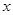
2H2O2
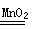 O2↑+2H2O
O2↑+2H2O 68 32
x 3.2g
68:32=x:3.2g
解得x=6.8g
反应前过氧化氢溶液中溶质质量分数=6.8g/100g×100%="10%"
(3)结果可能会偏大的原因有:该反应放热使水分蒸发,使质量减少得更多,从而是氧气的质量增大

练习册系列答案
相关题目

 2H2O+O2↑)
2H2O+O2↑)
 4FeO+CO2↑.试计算应向160gFe2O3粉末中加入木炭粉的质量.
4FeO+CO2↑.试计算应向160gFe2O3粉末中加入木炭粉的质量.