题目内容
某兴趣小组对生锈废铁锅中铁的含量进行了测定。生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应)。兴趣小组的同学称取40 g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到恰好反应完全停止加入稀硫酸(假设硫酸先与表面的铁锈发生反应),实验数据如图所示。

(1)废铁锅片中铁单质的质量分数为 。
(2)所得溶液中所含溶质的化学式为 ,请计算溶液中硫酸铁的质量为 g(请写出计算过程)。

(1)废铁锅片中铁单质的质量分数为 。
(2)所得溶液中所含溶质的化学式为 ,请计算溶液中硫酸铁的质量为 g(请写出计算过程)。
(1)70% (2)FeSO4 、Fe2(SO4)3 10
试题分析:(1)观察图示,可知稀硫酸与铁反应生成氢气的质量为1 g,根据铁与盐酸反应的方程式,由氢气的质量求出铁的质量,再计算出铁单质的质量分数。
设废铁锅中铁的质量为x 。
Fe + H2SO4 = FeSO4 + H2↑
56 2
x 1 g
56/2 = x/1g,解得x = 28g 废铁锅中铁单质的质量分数为28g/40g×100% = 70%
(2)废铁锅中只有Fe和Fe2O3能与稀硫酸反应,并且稀硫酸恰好完全反应,所以溶液中的溶质是稀硫酸与Fe反应产生的FeSO4以及稀硫酸与Fe2O3反应产生的Fe2(SO4)3。
由题意及图可以看出与Fe2O3反应的纯硫酸的质量为18.75g×39.2% = 7.35g,设反应生成硫酸铁的质量为y
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
294 400
7.35 g y
294/400 =7.35g/y ,解得y = 10g
答:溶液中硫酸铁的质量为10g

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
 MnSO4+H2O+CO2↑)
MnSO4+H2O+CO2↑)  Na2SO4+2NH3↑+2H2O,
Na2SO4+2NH3↑+2H2O,
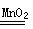 2H2O+O2↑)
2H2O+O2↑)