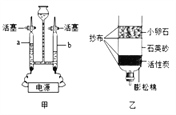
��Ŀ����
����Ŀ��ͨ����ѧ�仯�����Ʊ����ʡ�
��1��ij��ȤС������200 g 4%������������Һ���ն�����̼�Ʊ�̼���ƣ���Ӧ�Ļ�ѧ����ʽ��___����Ҫ���ṩ����������ȫ��ת��Ϊ̼���ƣ����г������������̼������x���ı���ʽ_____��
��2����ʵ���У���С��ͬѧ���֣�Ҫ��������ͨ������������Һ�ж�����̼��������������Բ������������ͨ�������̼�����������ʱ�ᵼ�²����л��е�������_____��
��3���������ϣ�
Na2CO3��CO2��H2O===2NaHCO3��NaHCO3��NaOH===Na2CO3��H2O��
��С��ͬѧ���Ʊ������Ľ����£�
���� | ʵ����� | ʵ��Ŀ�� |
һ | ��200g 4%��NaOH��Һ��Ϊ���ȷ� | / |
�� | ��_____ | ������һ����Һ�е�NaOHȫ��ת��ΪNaHCO3 |
�� | �������������ҺС�����1��2���� | ��___ |
�� | ��___ | ��NaHCO3ȫ��ת��ΪNa2CO3 |
��4������ÿ��ת������ȫ����С��ͬѧ���øĽ���ķ�����ȡ��̼��������m1��___g������ʦָ������С��ͬѧ�������ķ�Ӧ�����Һ���ɲ�������յõ�̼���Ʒ�ĩ������Ϊm2g������m1��m2���ɴ�֤�����ǵķ����Ľ��ɹ���
���𰸡� 2NaOH��CO2===Na2CO3��H2O ![]() �������ƣ� �����е�һ������������ͨ������Ķ�����̼ ��ȥ�ܽ�����Һ�еĶ�����̼ ����һ������������Һ�벽����������Һ��ֻ�� 10.6
�������ƣ� �����е�һ������������ͨ������Ķ�����̼ ��ȥ�ܽ�����Һ�еĶ�����̼ ����һ������������Һ�벽����������Һ��ֻ�� 10.6
��������
��1���������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ����Ӧ����ʽΪ2NaOH��CO2===Na2CO3��H2O��
�μӷ�Ӧ���������Ƶ�����Ϊ��200g��4%��8g������Ҫ������̼��������x��
2NaOH��CO2===Na2CO3��H2O
80 44
8g x
![]()
��2���������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ��ͨ�������̼�����������ʱ�ᵼ�²����л��е�ʣ����������ƣ�
��3����ʵ���Ŀ���ǽ���������ȫ��ת��Ϊ̼�����ƣ���ʵ�����Ϊ������������Һ��ͨ������Ķ�����̼���壻�ڶ�����̼�ɲ����ܽ�����Һ�У��ʽ������������ҺС�����1��2����Ŀ���dz�ȥ�ܽ�����Һ�еĶ�����̼����̼�����ƺ��������Ʒ�Ӧ����̼���ƺ�ˮ��������̼���������Ʒ�Ӧ����̼���ƺ�ˮ����Ҫ��̼������ȫ��ת��Ϊ̼���ƣ�������һ������������Һ�벽����������Һ��ֻ�ϣ�ʹ̼���������������Ʒ�Ӧ����̼���ƣ�
��4��NaOH��Һ����Ԫ��ȫ��ת����̼���ƣ�������̼���Ƶ�����Ϊm1������
2NaOH��������������2Na������������Na2CO3��
80 46 106
200g��4% m1
![]() =
=![]() ��m1=10.6g
��m1=10.6g
���ԣ�����̼���Ƶ�����Ϊ10.6g��

 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�