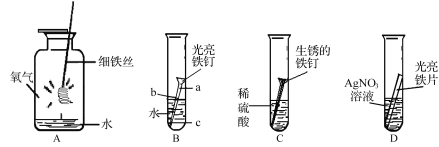
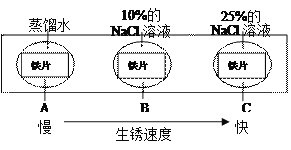
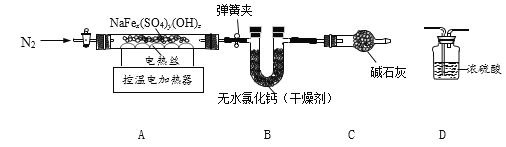
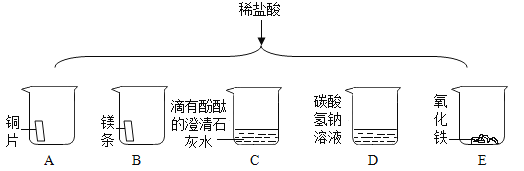
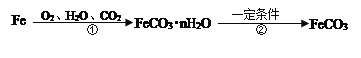题目内容
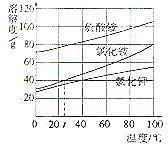
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
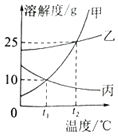
A. 蒸发溶剂可使丙的饱和溶液变为不饱和溶液
B. t2℃时,100g甲的饱和溶液降温至t1℃,析出甲的质量为15g
C. t1℃时,甲、乙、丙三种溶液所含溶质的质量可能相同
D. t2℃时,甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为乙>甲=丙
【答案】C
【解析】
根据固体的溶解度曲线可以①查出某物质在一定温度下的溶解度,从而确定物质的溶解性;②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、蒸发溶剂后,丙的饱和溶液仍为饱和溶液,错误;B、t2℃时,甲物质的溶解度是25g,所以125g甲的饱和溶液降温至t1℃,析出甲的质量为15g,错误;C、t1℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等,所以甲、乙、丙三种溶液所含溶质的质量可能相同,正确;D、t1℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等,降低温度,甲、乙物质的溶解度减小,丙物质的溶解度增大,应该按照t2℃时的溶解度计算,所以t2℃时,甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为乙>甲>丙,错误。
故选C。

【题目】下表是NaCl和Na2CO3在不同温度下的溶解度,下列说法中不正确的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | NaCl | 35.0 | 35.5 | 36.0 | 36.5 | 37.0 |
Na2CO3 | 6.0 | 10.0 | 18.0 | 36.5 | 50.0 | |
A. 两种物质溶解度相等的温度在30℃
B. 生活在盐碱湖附近的人们习惯“夏天晒盐、冬天捞碱”
C. 40℃时,5gNaCl中加10g水可得溶质质量分数为26.3%的溶液
D. 40℃时,9g Na2CO3中加20g水,充分溶解后再降温到10℃,析出固体的质量为7g
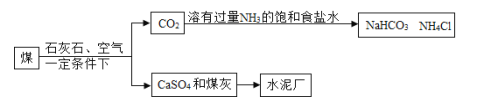
【题目】通过化学变化可以制备物质。
(1)某兴趣小组欲用200 g 4%的氢氧化钠溶液吸收二氧化碳制备碳酸钠,反应的化学方程式是___;若要将提供的氢氧化钠全部转化为碳酸钠,请列出计算需二氧化碳质量(x)的比例式_____;
(2)在实验中,该小组同学发现,要定量控制通入氢氧化钠溶液中二氧化碳气体的质量,难以操作。请分析若通入二氧化碳气体的量不足时会导致产物中混有的杂质是_____;
(3)查阅资料:
Na2CO3+CO2+H2O===2NaHCO3;NaHCO3+NaOH===Na2CO3+H2O;
该小组同学将制备方案改进如下:
步骤 | 实验操作 | 实验目的 |
一 | 将200g 4%的NaOH溶液分为两等份 | / |
二 | ①_____ | 将其中一份溶液中的NaOH全部转化为NaHCO3 |
三 | 将步骤二所得溶液小心煮沸1~2分钟 | ②___ |
四 | ③___ | 将NaHCO3全部转化为Na2CO3 |
(4)假设每步转化都完全,该小组同学利用改进后的方案制取的碳酸钠质量m1=___g;经老师指导,该小组同学将步骤四反应后的溶液蒸干并充分灼烧得到碳酸钠粉末的质量为m2g,发现m1=m2,由此证明他们的方案改进成功。