题目内容
【题目】今年世界环境日的主题是“营造绿色城市,呵护地球家园”。某科学探究小组为探究影响大气“温室效应”的因素,进行太阳光照射下N2 、O2、CO2及空气温室效应强度的比较实验。请你参与他们的探究过程,填写有关空格。
(1) 用500mL集气瓶装满一瓶空气。
(2) 另取一个500mL的集气瓶,采用采用排水法收集从液氮瓶和液氧瓶中放出的N2、氧气。
(3) 现欲制取并收集一瓶500mL二氧化碳气体,有下列仪器供选用:
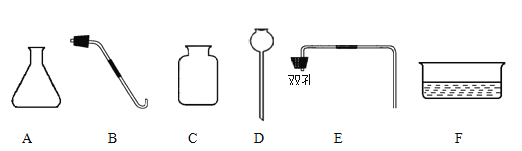
①实验室制取二氧化碳药品的名称是
②制取并收集二氧化碳气体所需的仪器是(填仪器序号)
③验证二氧化碳气体是否集满的方法是
④写出实验室检验二氧化碳气体的化学方程式:
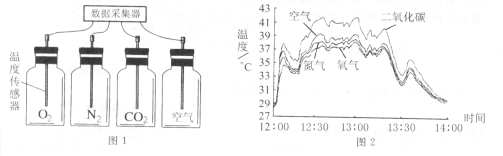
(4) 将制得的N2、O2、CO2及空气4瓶气体放在室外的太阳光下,在互相不遮太阳光的条件下尽量使集气瓶靠近,以保证地表和光照条件相同。将温度传感器插入4个集气瓶中,连接好装置(如图l所示)。打开数据采集器,实验时间从北京时间12∶00到14∶00,测得此期间4种气体在太阳光照射下的温度变化情况如图2所示。由图2分析,在实验的大部分时间内4瓶气体的温度由高到低的顺序是:
(5) 我们安徽省是最早实行乙醇汽油(是用90%的普通汽油与10%的燃料乙醇调和而成)的试点之一,能否从根本上避免温室效应的发生? (填“能”或“不能”)
理由是:
(6) 秋收季节,一些农民将收割水稻后的千杆就地焚烧,这种做法的危害主要有:
, (至少说出两点)
为了减缓大气中二氧化碳含量的增加, ,
【答案】① 稀盐酸和石灰石 ② A、C、D、E ③把点燃的木条放在集气瓶的瓶口,如果熄灭,说明已经收集满了二氧化碳。 ④ CO2+Ca(OH)2=CaCO3↓+H2O(4)二氧化碳>空气>氮气>氧气 (5)不能 只要含碳元素的物质燃烧都会产生二氧化碳。(6)产生大量的二氧化碳、产生大量的粉尘。(7)开发太阳能、风能、水能。地热能等新能源。(少使用煤、石油、天然气等含碳的矿物燃料,禁止乱砍滥伐。)
【解析】
试题分析:① 实验室用稀盐酸和石灰石为原料来制取二氧化碳。②根据所给仪器,制取并收集二氧化碳的仪器是锥形瓶、集气瓶、长颈漏斗、带有导气管的双孔塞。③ 验证二氧化碳气体是否集满的方法是:把带有火星的小木条放在集气瓶的瓶口,观察燃烧的木条是否熄灭。④ 实验室检验二氧化碳气体的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O(4)根据题给信息,可分析出4瓶气体的温度由高到低的顺序是:二氧化碳>空气>氮气>氧气 。(5) 乙醇中含有碳元素,燃烧后有二氧化碳生成,因此使用乙醇汽油不能从根本上避免温室效应。(6)植物的秸秆中含碳元素,燃烧后生成二氧化碳,并且产生大量的烟尘,会对空气造成污染。(7)减缓大气中二氧化碳的含量,可以从三方面入手:一是少用化石燃料,减少二氧化碳的排放;二是多植树,因为植物光合作用需要消耗二氧化碳,再就是开发新能源。

 阅读快车系列答案
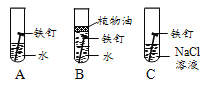
阅读快车系列答案【题目】一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种。某小组为探究其成分进行如下实验:
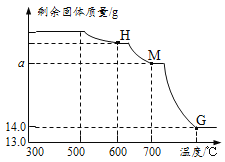
Ⅰ. 取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图1所示
Ⅱ. 取少量B点时的清液于试管中,滴加酚酞溶液,酚酞变红
Ⅲ. 向实验Ⅰ所得的混合物中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。
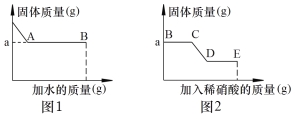
① CD段可观察到的现象是 (9) ,从D到E的溶液的pH (10) (填“增加”、“减小”、“不变”)。
② 根据上述实验得出原固体中一定有 (11) 。
③ 为进一步探究该白色固体成分,进行如下实验
步骤 | 现象 | 结论 |
取实验Ⅱ反应后的溶液于试管中, 加入 (12) | (13) | 原固体中有氢氧化钠 |
取实验Ⅱ反应后的溶液于试管中, 加入过量硝酸酸化,再加入硝酸银 | (14) | (15) |
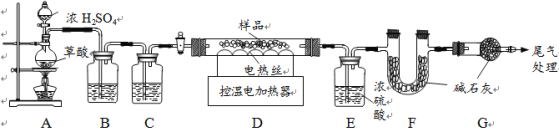
【题目】某氮肥硫酸铵中混有硫酸氢铵。为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用。已知:
氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+X+2H2O
(1)根据上述信息,回答下列问题
①氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+X+2H2O,该反应中X的化学式为 。
②“化肥用得巧 庄稼‘身体好’”,下列物质可作为植物生长所需肥料的是 。
A.CaCl2 B.Ca3(PO4)2 C.K2CO3 D.KNO3
(2)氨气是一种无色、有强烈刺激性气味的气体,极易溶于水.水溶液呈碱性.实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气.某兴趣小组的同学设计如图G~J所示装置对氨气的制取、性质进行探究.
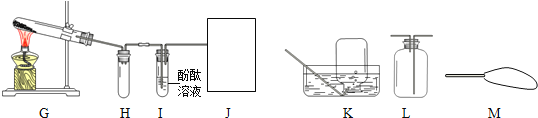
①装置I中的现象是 。②装置H的作用是 。
③根据氨气的性质,J处应选择的最佳收集装置为 .(填“K”、“L”或“M”)
(3)同学们设计的实验装置图如右,请回答相关问题。
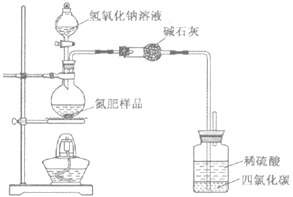
①装置中碱石灰的作用是 ,广口瓶内四氯化碳的作用是 。
②指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是 。
(4)同学们改进实验装置后(改进装置图略),进行如下实验。
称取不同质量的上述样品分别与100g相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量。部分实验数据如下:
氢氧化钠溶液的质量(g) | 100 | ||
样品质量(g) | 7.750 | 15.50 | 23.25 |
氨气质量(g) | 1.870 | 1.870 | 1.700 |
请计算(计算结果保留两位小数):样品中氮元素的质量分数是 %。