题目内容
【题目】目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)铁的广泛应用
某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为 。
(二)铁锈成分的探究
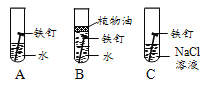
(1)右图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是 (选填序号)。
(2).铁生锈的主要过程为:Fe ![]() Fe(OH)2
Fe(OH)2 ![]() Fe(OH)3
Fe(OH)3 ![]() Fe2O3·xH2O
Fe2O3·xH2O
次要过程为:Fe ![]() FeCO3
FeCO3
写出Fe ![]() Fe(OH)2反应的化学方程式 。
Fe(OH)2反应的化学方程式 。
(3).铁锈组成成分的确定
某铁锈成分为Fe2O3·xH2O和FeCO3。为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用下图装置进行实验。
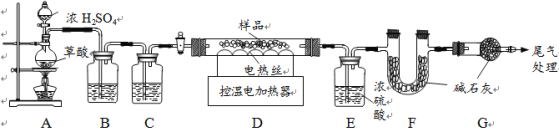
【查阅资料】①Fe2O3·xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2。②温度高于500℃时铁的氧化物才能被CO还原。③碱石灰的主要成分是氢氧化钠和氧化钙。
①装配好实验装置后,首先要 。
②装置A中的反应为:H2C2O4 (草酸) ![]() CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
③现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g。
则样品中FeCO3的质量m(FeCO3)= g,x= 。
④若缺少G装置,测得的m(FeCO3) (选填“偏大”、“偏小”、“不变”,下同),
x的值会 。
(三)炼铁过程的探究
⑴.写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式 。
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO![]() Fe+CO2
Fe+CO2
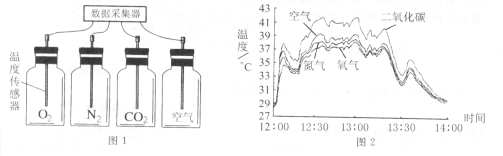
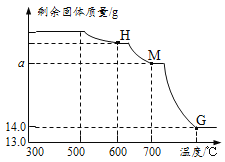
⑵.将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼
铁过程的探究。加热时测定D中剩余固体质量随温度变化的曲线如右图所示。图中M点对应的a= 。
【答案】㈠Fe+2HCl![]() FeCl2+H2↑
FeCl2+H2↑
㈡⑴C⑵2Fe+O2+2H2O![]() 2Fe(OH)2⑶①查装置的气密性②c③5.8、2④偏大、偏大
2Fe(OH)2⑶①查装置的气密性②c③5.8、2④偏大、偏大
㈢①Fe2O3+3CO![]() 2Fe+3CO2②18
2Fe+3CO2②18
【解析】
试题分析:㈠ 胃酸的主要成分是盐酸,可与铁发生置换反应,反应方程式为:Fe+2HCl![]() FeCl2+H2↑
FeCl2+H2↑
㈡⑴铁与氧气、水同时接触时容易生锈,与盐、酸接触时更容易生锈,故选C;
⑵铁与氧气和水同时反应生成氢氧化亚铁,反应方程式为:2Fe+O2+2H2O![]() 2Fe(OH)2;
2Fe(OH)2;
⑶①装配好实验装置后,先检查装置的气密性,再进行实验;②要得到干燥、纯净的一氧化碳,应先去除二氧化碳,再进行干燥,故B瓶中应该装的是吸收二氧化碳的物质,选c;③浓硫酸有吸水性,碱石灰会与二氧化碳反应,加热到了300℃,一氧化碳不会还原氧化铁,浓硫酸增加的质量是水的质量,来自铁锈,碱石灰增加的质量来自碳酸亚铁分解生成的二氧化碳,所以依据碳元素守恒进行计算,设碳酸亚铁的质量为y,![]() ,y=5.8g;由此可知,Fe2O3·xH2O的质量为25.4g-5.8g=19.6g,根据氢元素守恒,
,y=5.8g;由此可知,Fe2O3·xH2O的质量为25.4g-5.8g=19.6g,根据氢元素守恒,![]() ,x=2;④G装置中的碱石灰能吸收空气中的二氧化碳和水,若缺少G装置,会导致F装置中收集的二氧化碳的质量偏大,从而测得的FeCO3的质量偏大;Fe2O3·xH2O中x偏大。
,x=2;④G装置中的碱石灰能吸收空气中的二氧化碳和水,若缺少G装置,会导致F装置中收集的二氧化碳的质量偏大,从而测得的FeCO3的质量偏大;Fe2O3·xH2O中x偏大。
㈢①工业上用赤铁矿炼铁的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
②根据题意可知,加热到300℃,FeCO3分解为FeO,继续升温,一氧化碳还原铁的氧化物,加热到700℃,氧化铁被一氧化碳还原为氧化亚铁,故M点的质量为碳酸亚铁分解与氧化铁被还原得到的氧化亚铁之和。 根据铁元素守恒,设碳酸亚铁分解生成的氧化亚铁的质量为m,
FeCO3~FeO
116 72
5.8g m
![]()
m=3.6g
Fe2O3·2H2O的质量为19.6g,Fe2O3的质量为![]() ,
,
设氧化铁生成的氧化亚铁的质量为n
Fe2O3~2FeO
160 2×72
16g n
![]()
n=14.4g
所以M点对应的a=3.6g+14.4g=18g