题目内容
【题目】某氮肥硫酸铵中混有硫酸氢铵。为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用。已知:
氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+X+2H2O
(1)根据上述信息,回答下列问题
①氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+X+2H2O,该反应中X的化学式为 。
②“化肥用得巧 庄稼‘身体好’”,下列物质可作为植物生长所需肥料的是 。
A.CaCl2 B.Ca3(PO4)2 C.K2CO3 D.KNO3
(2)氨气是一种无色、有强烈刺激性气味的气体,极易溶于水.水溶液呈碱性.实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气.某兴趣小组的同学设计如图G~J所示装置对氨气的制取、性质进行探究.
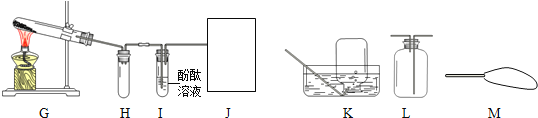
①装置I中的现象是 。②装置H的作用是 。
③根据氨气的性质,J处应选择的最佳收集装置为 .(填“K”、“L”或“M”)
(3)同学们设计的实验装置图如右,请回答相关问题。
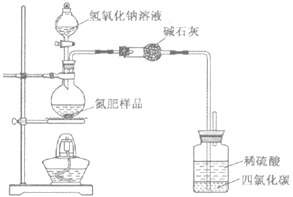
①装置中碱石灰的作用是 ,广口瓶内四氯化碳的作用是 。
②指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是 。
(4)同学们改进实验装置后(改进装置图略),进行如下实验。
称取不同质量的上述样品分别与100g相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量。部分实验数据如下:
氢氧化钠溶液的质量(g) | 100 | ||
样品质量(g) | 7.750 | 15.50 | 23.25 |
氨气质量(g) | 1.870 | 1.870 | 1.700 |
请计算(计算结果保留两位小数):样品中氮元素的质量分数是 %。
【答案】(1)①NH3②BCD(2)①变红②防止倒吸③L(3)①干燥气体;因为氨气不与四氯化碳反应,所以只产生一个一个气泡,气泡上浮被稀硫酸吸收,又因为气泡不是连续的,所以稀硫酸到不了导管中,这个装置还可以防倒吸②管内和瓶内残留氨气(4)19.9%
【解析】
试题分析:氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+X+2H2O,该反应中X的化学式可以根据质量守恒定律确定为NH3。②“化肥用得巧 庄稼‘身体好’”,可作为植物生长所需肥料的是B.Ca3(PO4)2 C.K2CO3 D.KNO3,分别是磷肥、氮肥、复合肥;装置I中的现象是变红,因为氨气具有碱性。②装置H的作用是防止倒吸。③根据氨气的性质,J处应选择的最佳收集装置为L,因为氨气能够溶于水中;①装置中碱石灰的作用是 干燥气体 ,广口瓶内四氯化碳的作用是因为氨气不与四氯化碳反应,所以只产生一个一个气泡,气泡上浮被稀硫酸吸收,又因为气泡不是连续的,所以稀硫酸到不了导管中,这个装置还可以防倒吸②管内和瓶内残留氨气。
即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低。从实验方案的数据看出,第一个实验和第二个实验中生成的氨气质量相同,说明第一个实验中氢氧化钠是过量的,所有铵离子都生产了氨气,根据氮元素守恒,氮元素的质量=14/17×1.870克=1.54克;样品中氮元素的质量分数是=1.54克/7.750×100%= 19.9%

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】除去下列物质中的少量杂质,方法错误的是
选项 | 物质 | 所含杂质 | 除杂质的方法 |
A | CO | CO2 | 通过足量的氢氧化钠溶液,干燥 |
B | Cu | Fe | 加入足量的稀硫酸,过滤,洗涤,干燥 |
C | CaO | CaCO3 | 加入适量的稀盐酸,过滤,洗涤,干燥 |
D | KCl溶液 | CuCl2 | 加入适量的氢氧化钾溶液,过滤 |
A.A B.B C.C D.D