题目内容
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑),这种工业成为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究。
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是 (用化学方程式表示) 猜想二:可能含有NaCl,作出此猜想的依据是 (用简洁的文字表述)。
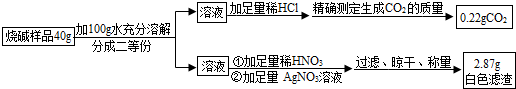 II.定量探究
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程)。
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性。
(2)探究方案中因缺少 (填操作名称),导致测得的氢氧化钠的质量分数偏小。
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是 (用化学方程式表示) 猜想二:可能含有NaCl,作出此猜想的依据是 (用简洁的文字表述)。
 II.定量探究
II.定量探究【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程)。
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性。
(2)探究方案中因缺少 (填操作名称),导致测得的氢氧化钠的质量分数偏小。

 从电解后溶液中析出时有少量
从电解后溶液中析出时有少量 同时析出
同时析出91.5% 洗涤
试题分析:【猜想】猜想一:由于氢氧化钠能与空气中的二氧化碳反应,生成碳酸钠和水,即CO2+2NaOH=Na2CO3+H2O,因此烧碱样品中可能有碳酸钠。 猜想二:由于氯化钠可能没有全部反应,因此可能有氯化钠的剩余,所以烧碱样品中可能有氯化钠杂质。
【设计实验】根据题意,向烧碱样品中加入稀盐酸,有二氧化碳气体的生成,说明样品中含有碳酸钠,并可由二氧化碳的质量,结合反应的化学方程式,求出碳酸钠的质量;另向烧碱样品中加入稀硝酸和硝酸银,有白色沉淀生成,说明样品中含有氯化钠,并可由氯化银沉淀的质量,结合反应的化学方程式,求出氯化钠的质量。
解,设20g样品中含有碳酸钠的质量为x,氯化钠的质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 0.22g
106:x=44:0.22g
解得,x=0.53g
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
y 2.87g
58.5:y=143.5:2.87g
解得,y=1.17g
则氢氧化钠的质量分数=
 ×100%=91.5%,
×100%=91.5%,答:氢氧化钠的质量分数是91.5%
【交流与反思】根据题意,小婉同学在过滤得到氯化银沉淀后,没有洗涤,直接晾干称量,这样氯化银表面就会有氢氧化钠溶液的附着,所以称得的质量偏大,则计算的氯化钠的质量就偏大,故导致测得的氢氧化钠的质量分数偏小。
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等;关于根据化学反应方程式的计算,难度不大,只要根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

练习册系列答案
相关题目


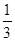 体积的NaOH溶液,发现塑料瓶变瘪。小敏宣布验证了CO2与NaOH发生了反应。
体积的NaOH溶液,发现塑料瓶变瘪。小敏宣布验证了CO2与NaOH发生了反应。






