题目内容
【题目】晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅,同时得到一种可燃性气体。
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:_____。
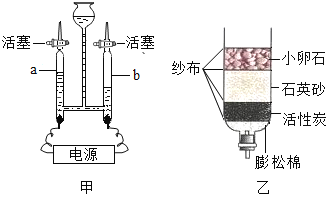
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
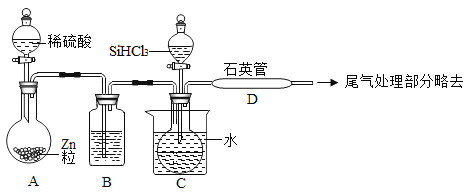
①装置B中的试剂是_____,装置C中的烧瓶需要加热,其目的是:_____。
②装置D不能采用普通玻璃管的原因是_____,装置D中发生反应的化学方程式为_____。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_____。
【答案】SiO2+2C![]() Si+2CO↑ 分馏(或蒸馏) 浓硫酸 使滴入烧瓶中的SiHCl3气化 在该反应温度下,普通玻璃会软化 SiHCl3+H2
Si+2CO↑ 分馏(或蒸馏) 浓硫酸 使滴入烧瓶中的SiHCl3气化 在该反应温度下,普通玻璃会软化 SiHCl3+H2![]() Si+3HCl 排尽装置中的空气
Si+3HCl 排尽装置中的空气
【解析】
高温下用碳还原二氧化硅制得粗硅和一氧化碳,锌和稀硫酸反应生成硫酸锌和氢气。
(1)高温下用碳还原二氧化硅制得粗硅和一氧化碳,第①步制备粗硅的化学反应是方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:分馏(或蒸馏)。
(3)锌和稀硫酸反应生成硫酸锌和氢气,装置B是干燥氢气,故①装置B中的试剂是浓硫酸,装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3气化。
②反应的温度为1000~1100℃,故装置D不能采用普通玻璃管的原因是在该反应温度下,普通玻璃会软化,装置D中发生反应为SiHCl3和氢气在高温下生成硅和氯化氢,反应的化学方程式为
SiHCl3+H2![]() Si+3HCl。
Si+3HCl。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】人类的生活和生产都离不开金属,铁是世界产量最高且应用最广泛的金属。
(1)生活中用铁锅作炊具,是利用了铁的____性;
(2)铁制品生锈的主要条件是铁与____直接接触,铁锈的主要成分是____(填化学式);防止铁生锈的方法有____(答一种即可)。
(3)Pb的化合价有+2和+4价,Pb3O4属氧化物,也属于盐,其盐的化学式可表示为Pb2(PbO4),铁的氧化物Fe3O4也属于盐,则其盐的化学式可表示为____;
(4)取某钢样粉末50.0 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到2.5 g白色沉淀。另取三份不同质量的该钢样粉末分别加入到100.0 g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | 甲 | 乙 | 丙 |
加入钢样粉末的质量(g) | 10.0 | 20.0 | 40.0 |
生成气体的质量(g) | 0.355 | 0.71 | 1.0 |
①根据表中数据可计算出稀硫酸中H2SO4的质量分数为____;
②若要使实验甲中的剩余硫酸全部消耗完,则至少需要再加入____g钢样粉末。