题目内容
【题目】下列实验设计能达到实验目的是
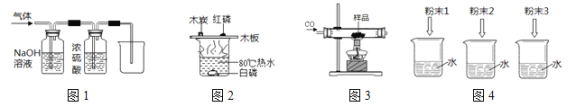
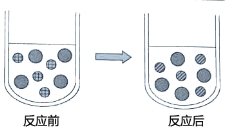
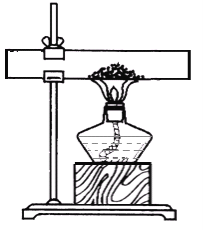
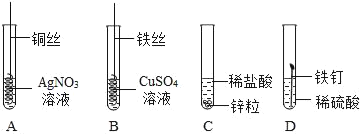
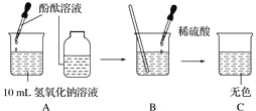
A. 用图1装置除去CO中的CO2,回收COB. 用图2装置探究可燃物燃烧所需的条件
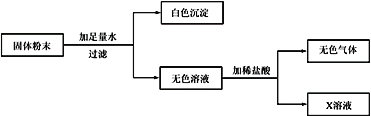
C. 用图3装置除去氧化铜样品中的铜粉D. 用图4鉴别NH4NO3、CuSO4和NaCl 三种白色粉末
【答案】D
【解析】
A、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则,但一氧化碳有毒、密度与空气接近,不能用排空气法收集,且不能用烧杯收集,故错误;
B、可燃物燃烧所需的条件是有氧气、达到着火点,两者缺一不可,木板上的木炭应换成白磷,故错误;
C、一氧化碳与氧化铜反应生成铜单质和二氧化碳,把反应物反应掉,不符合除杂原则,故错误;
D、NH4NO3溶于水吸热,使温度降低;CuSO4溶于水形成蓝色溶液,NaCl溶于水形成无色溶液,但温度几乎无变化,可以鉴别,故正确;
故选:D。

练习册系列答案
相关题目
【题目】根据表中内容回答下列问题。
温度 溶解度 物质 | 0 | 20 | 40 | 60 | 80 |
|
|
|
| 110 | 169 |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
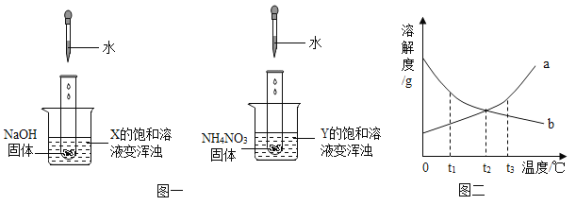
![]() 随温度升高,
随温度升高,![]() 溶解度的变化趋势是______
溶解度的变化趋势是______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是______。
根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是______。
![]() 取
取![]() 、NaCl两种固体各36g分别放入
、NaCl两种固体各36g分别放入![]() 时的100g水中充分溶解,
时的100g水中充分溶解,![]() 时存在如图1所示的实验现象,烧杯b中溶解的物质是______;烧杯a所得溶液溶质的质量分数是______
时存在如图1所示的实验现象,烧杯b中溶解的物质是______;烧杯a所得溶液溶质的质量分数是______![]() 结果精确到
结果精确到![]() ,若要使其溶质质量分数增大可采用的方法是______。
,若要使其溶质质量分数增大可采用的方法是______。
![]() 如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是______。
如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是______。