题目内容
【题目】现有一包固体粉末,可能由CaCO3、CaO、Fe2O3 、KNO3、Na2CO3中的一种或几种组成。
为确定其组成,进行了如下图所示的实验(假设实验过程无损耗)。请回答:
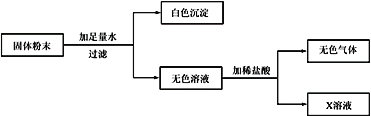
(1)白色沉淀是____;原固体粉末中一定含有___,该白色固体的可能组成有___种。
(2)氧化钙和水反应的化学方程式是____。
(3)若实验取固体粉末20.0g,生成白色沉淀10.0g,最后得到溶质质量分数为5.85%的X溶液200.0g(只含一种溶质),则原固体粉末由___组成。
【答案】碳酸钙(CaCO3) 碳酸钠(Na2CO3) 6 CaO+H2O=Ca(OH)2 碳酸钠、氧化钙、碳酸钙(或Na2CO3、CaO、CaCO3)
【解析】
把固体粉末加入水中,得到白色沉淀,根据题给的物质可以判断该白色沉淀为碳酸钙,得到的无色溶液与可以与稀盐酸反应生成无色气体,可以判断在无色溶液中含有碳酸钠,可以据此分析原固体粉末中一定含有碳酸钠,氧化铁是不溶于水的红棕色固体,所以一定不存在氧化铁,氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙,白色沉淀可能是原固体粉末中的,也可能是碳酸钠与氢氧化钙发生了反应而生成的,所以碳酸钙和氧化钙都为可能含有的物质,硝酸钾与固体粉末中的物质不能发生反应,且溶于水,所以硝酸钾是可能存在的物质,该白色固体的可能组成是①碳酸钠、氧化钙; ②碳酸钠、碳酸钙; ③碳酸钠、氧化钙、碳酸钙④碳酸钠、氧化钙、硝酸钾;⑤碳酸钠、碳酸钙、硝酸钾;⑥碳酸钠、氧化钙、碳酸钙、硝酸钾。
根据以上分析可知:
(1)白色沉淀是碳酸钙(CaCO3);原固体粉末中一定含有碳酸钠(Na2CO3),该白色固体的可能组成有6种;
(2)氧化钙与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2;
(3)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,若最后得到溶液中只含有一种溶质,则X为氯化钠,固体粉末中一定不存在硝酸钾,生成氯化钠的质量=200g×5.85%=11.7g,
设:生成11.7g氯化钠需要碳酸钠的质量为x。

![]() 解得x=10.6g
解得x=10.6g
这里我们求得的只是和盐酸反应的碳酸钠,总质量为20g,所以假如白色沉淀是固体粉末中的,则只有20g-10.6g=9.4g,题目中得到的白色沉淀的质量是10g,也就是说白色沉淀并不是完全来自于原固体粉末中,而是有一部分是反应中生成的,即氧化钙和水反应生成了氢氧化钙,而氢氧化钙又和碳酸钠反应生成了碳酸钙沉淀,从而可以判断在混合物中含有氧化钙。原固体粉末由碳酸钠、氧化钙、碳酸钙(或Na2CO3、CaO、CaCO3)组成。

【题目】碳酸钾是农家肥草木灰的主要成分,将它和化肥一起施用,会减少对环境的污染。为了帮助父母合理选择化肥,李明决定对碳酸钾的化学性质进行探究
(提供信息)钠原子和钾原子的结构示意图分别为:
(实验与探究)李明参照碳酸钠的化学性质设计了如下实验:
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
实验步骤 |
|
|
|
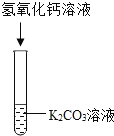
实验现象 | 溶液变红色 | 左边试管中有气泡产生,产生的气体能使右边澄清石灰水变浑浊。 | 产生___ |
实验结论 | 碳酸钾溶液显 ___性 | 写出碳酸钾能与稀盐酸反应的化学方程式:___ | 碳酸钾能与氢氧化钙溶液反应。 |
(解释与结论)
(1)碳酸钾溶液能使指示剂变色,能与某些酸或碱反应;
(2)碳酸钾与碳酸钠的化学性质相似;
(3)从微观角度分析,二者含有相同的CO32—。
(拓展与应用)李明建议父母最好选择__________(填字母序号)与草木灰混合施用。
A NH4NO3 B NH4Cl C CO(NH2)2