题目内容
【题目】煤燃烧后的煤灰粉末(主要含氧化铝、二氧化硅等物质)可制备碱式硫酸铝[Al2(OH)6-2X(SO4)X]溶液,并进行烟气脱硫的探究,其实验流程如下图所示:
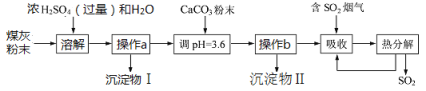
资料:二氧化硅难溶于水和酸,也不与其发生反应。H2SO3受热易分解,其酸性弱于H2SO4;H2SO4受热不易分解。
(I)Al2(OH)6-2X(SO4)X中铝元素的化合价为________。
(2)“溶解”时,先将煤灰粉末倒入烧杯中,接下来的具体操作是:___________,主要的反应方程式为_____________。
(3)操作a、b的名称为________,沉淀物Ⅰ的主要成分为_______________(填化学式)。
(4)不断加入CaCO3粉末使溶液的pH升高到3.6,其作用是____________________并使Al2(SO4)3转化为Al2(OH)6-2X(SO4)X。
(5)流程中,“热分解"时溶液中的部分H2SO3会被氧化为H2SO4,则完全“热分解”放出的SO2量总是__(填“大于”、“小于"或“等于”吸收的SO2量,“热分解"后循环利用的溶液pH_______(填“大于”、“小于"或“等于")吸收SO2之前的溶液
【答案】+3 加水,再沿着玻璃棒慢慢加入浓硫酸 Al2O3+3H2SO4═Al2(SO4)3+3H2O 过滤 SiO2 中和溶液中的酸 小于 小于
【解析】
粉煤灰(主要含Al2O3、SiO2等)和稀硫酸混合,发生反应Al2O3+3H2SO4═Al2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤溶液得沉淀物Ⅰ为SiO2,滤液中含有Al2(SO4)3,调节pH=3.6,加入CaCO3粉末,发生反应CaCO3+2H+═Ca2++CO2↑+H2O,CaSO4为微溶物,所以沉淀物Ⅱ的成分主要为CaSO4,过滤得滤液Ⅱ,二氧化硫和水反应生成的SO32-易被氧化生成SO42-,弱酸根离子转化为强酸根离子,据此解答;
(1)根据化合价的代数和为零,设铝元素的化合价为n,氢氧根离子的化合价为-1价,硫酸根离子化合价为-2价,则2n+(6-2X) ×(-1)+X×(-2)=0,解得n=+3,故铝元素的化合价为+3价;故填:+3;
(2)“溶解”时,先将煤灰粉末倒入烧杯中,接下来的具体操作是:加水,再沿着玻璃棒慢慢加入浓硫酸,发生反应为:Al2O3+3H2SO4═Al2(SO4)3+3H2O;
故填:加水,再沿着玻璃棒慢慢加入浓硫酸;Al2O3+3H2SO4═Al2(SO4)3+3H2O;
(3)操作a、b是将液体和固体分离,这个操作叫做过滤;SiO2和稀硫酸不反应,过滤溶液得沉淀物Ⅰ为SiO2;
故填:过滤;SiO2;
(4)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为易溶于水的Al2(SO4)x(OH)6-2x;故填:中和溶液中的酸;
(5)二氧化硫被吸收后生成SO32-,SO32-不稳定,易被氧化生成SO42-,所以流程中经完全热分解放出的SO2量总是小于吸收的SO2的量,加热分解后的溶液中硫酸根离子浓度增大,促进生成Al2(SO4)x(OH)6-2x,则溶液的酸性增强,溶液的pH减小;
故填:小于;小于。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
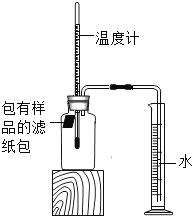
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。