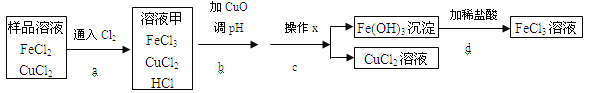
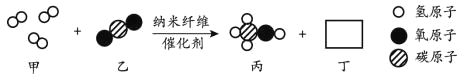
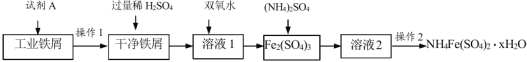
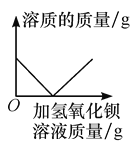
题目内容
【题目】工业上以硫铁矿为原料生产硫酸,有关工业流程图如下:
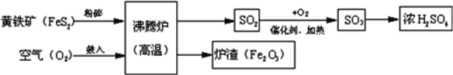
(1)硫铁矿的主要成分是FeS2,名称为二硫化亚铁,其中的硫元素化合价应为______。在加入沸腾炉之前,粉碎硫铁矿,是为了_______________________。
(2)该流程中涉及的空气污染气体是二氧化硫,形成的危害是_______。写出流程中SO2转化为SO3的化学方程式为_________________________________。
(3)实验室里将100g溶质质量分数为98%的浓硫酸稀释为10%的硫酸,需要水____g。需要的玻璃仪器有胶头滴管、玻璃棒、_______和______,此处玻璃棒的作用是_______。
(4)用稀硫酸可除去铁制品表面的铁锈,化学方程式为_____________________,硫酸在现代工业上还有哪些用途(只写一点即可)________________。
【答案】-1 增大反应物的接触面积 形成酸雨 2SO2+O2 2SO3 880 烧杯 量筒 搅拌散热,防止酸滴飞溅 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 生产化肥、农药、火药染料,冶炼金属,精炼石油。
2SO3 880 烧杯 量筒 搅拌散热,防止酸滴飞溅 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 生产化肥、农药、火药染料,冶炼金属,精炼石油。
【解析】
二氧化硫和水反应生成亚硫酸,形成酸雨,稀硫酸和氧化铁反应生成硫酸铁和水,化合物中各元素的正负化合价代数和为零,溶液稀释前后溶质质量不变。
(1)硫铁矿的主要成分是FeS2,名称为二硫化亚铁,铁元素的化合价为+2价,化合物中各元素的正负化合价代数和为零,设硫元素化合价为x,![]() ,
,![]() ,故硫元素化合价为-1价。在加入沸腾炉之前,粉碎硫铁矿,是为了增大反应物的接触面积,加快反应速率。
,故硫元素化合价为-1价。在加入沸腾炉之前,粉碎硫铁矿,是为了增大反应物的接触面积,加快反应速率。
(2)该流程中涉及的空气污染气体是二氧化硫,二氧化硫和水反应生成亚硫酸,随雨水降落,故形成的危害是形成酸雨。流程中SO2转化为SO3的化学方程式为2SO2+O2 2SO3
2SO3
(3)实验室里将100g溶质质量分数为98%的浓硫酸稀释为10%的硫酸,溶液稀释前后溶质质量不变,设需要水的质量为x,![]() ,
,![]() ,故需要水880g。量取液体需要量筒、胶头滴管,混匀需要烧杯、玻璃棒,故需要的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,操作中玻璃棒的作用是搅拌散热,防止酸滴飞溅。
,故需要水880g。量取液体需要量筒、胶头滴管,混匀需要烧杯、玻璃棒,故需要的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,操作中玻璃棒的作用是搅拌散热,防止酸滴飞溅。
(4)用稀硫酸可除去铁制品表面的铁锈,反应是稀硫酸和氧化铁反应生成硫酸铁和水,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,硫酸在现代工业上用途生产化肥、农药、火药染料,冶炼金属,精炼石油。

【题目】武汉将成为我国首个新型氢能城市。某化学兴趣小组在老师的帮助下围绕氢气的燃烧实验开展如下探究:
(1)点燃氢气前,一定先要________。点燃纯净的氢气可以看到淡蓝色火焰现象,该反应的化学方程式为________,该反应的基本类型为______反应。
(2)研究氢气燃烧实验,需要用试管收集不同体积比的氢气与空气的混合物,若用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,其操作方法为________。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
氢气与空气体积比 | 9:1 | 8:2 | 7:3 | 5:5 | 3:7 | 1:9 | 0.5:9.5 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱的 爆鸣声 | 强的 爆鸣声 | 强的 爆鸣声 | 弱的 爆鸣声 | 不燃烧 不爆鸣 |
请分析上表信息,你对燃烧或燃烧条件的新认识是可燃物能否燃烧除具备燃烧条件,还要考虑到________。