题目内容
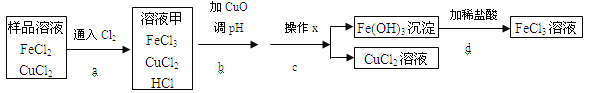
【题目】FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验。
该实验小组同学通过查阅资料,进行了尝试。
【阅读资料:】
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。右表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
[来源:学#科#网]
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)进行操作x时,应用到的仪器有:铁架台、玻璃棒、烧杯和 。
(2)实验中,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式 ;你认为步骤b调节溶液的pH到 (填数值范围)比较合适。
(3)实验中,步骤d加稀盐酸前,因缺少 (填操作名称)而使获得的氯化铁溶液不纯。
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用 (用字母表示)最合理。
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
【答案】(1)漏斗 (2)CuO+2HCl CuCl2+H2O 3.2≤pH<4.7 (3)洗涤 (4)C
【解析】
试题分析:进行操作x是过滤,进行时,应用到的仪器有:铁架台、玻璃棒、烧杯和漏斗;盐酸与氧化铜反应的化学方程式CuO+2HCl CuCl2+H2O;根据氢氧化铁的沉淀要求是PH值在3.2,而氢氧化铜的沉淀 PH值要在4.7,所以步骤b调节溶液的pH到3.2≤pH<4.7即可;实验中,步骤d加稀盐酸前,因缺少洗涤,可能还带有一部分溶质,FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,一般选稀盐酸,加入硫酸和硝酸都会产生新的杂质。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案