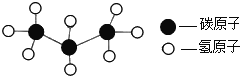
题目内容
【题目】武汉将成为我国首个新型氢能城市。某化学兴趣小组在老师的帮助下围绕氢气的燃烧实验开展如下探究:
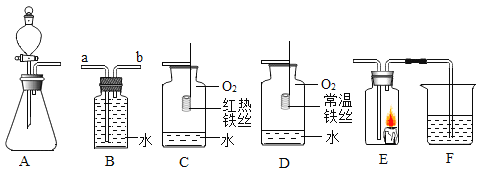
(1)点燃氢气前,一定先要________。点燃纯净的氢气可以看到淡蓝色火焰现象,该反应的化学方程式为________,该反应的基本类型为______反应。
(2)研究氢气燃烧实验,需要用试管收集不同体积比的氢气与空气的混合物,若用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,其操作方法为________。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
氢气与空气体积比 | 9:1 | 8:2 | 7:3 | 5:5 | 3:7 | 1:9 | 0.5:9.5 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱的 爆鸣声 | 强的 爆鸣声 | 强的 爆鸣声 | 弱的 爆鸣声 | 不燃烧 不爆鸣 |
请分析上表信息,你对燃烧或燃烧条件的新认识是可燃物能否燃烧除具备燃烧条件,还要考虑到________。
【答案】检验纯度 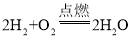 化合 试管先装入8mL水,用拇指堵住试管口,倒扣在水槽中,用排水法收集氢气,将剩余的水排出 与可燃物的浓度(或纯度)有关(或其他合理答案)
化合 试管先装入8mL水,用拇指堵住试管口,倒扣在水槽中,用排水法收集氢气,将剩余的水排出 与可燃物的浓度(或纯度)有关(或其他合理答案)
【解析】
(1)氢气具有可燃性,点燃不纯的氢气可能会发生爆炸,所以点燃氢气前,一定先要检验纯度。纯净的氢气能安静的燃烧,产生淡蓝色火焰,产物是水,反应的化学方程式为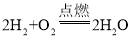 ,该反应是两种物质生成一种物质,属于化合反应。
,该反应是两种物质生成一种物质,属于化合反应。
(2)用容积为10mL试管收集氢气与空气体积比为4:1的混合气体,则氢气为8mL,空气为2mL。操作方法是试管先装入8mL水,用拇指堵住试管口,倒扣在水槽中,用排水法收集氢气,将剩余的水排出。
(3)从表中数据分析可知,可燃物能否燃烧除具备燃烧条件,还要考虑到反应物的浓度。

【题目】化学研究小组在开展了“过氧化氢制取氧气的反应中二氧化锰的作用”之后,又进行了“寻找新的催化剂”的探究实验。
(提出问题 1)寻找“氧化铁能否用于过氧化氢溶液分解的催化剂”的证据?如果能, 它的催化效果如何?
(实验设计 1)
实 验 | 现 象 |
Ⅰ.分别量取 5 毫升 5%的过氧化氢溶液于 A、B 两支试管中,向 A 中加入 a 克氧化铁粉末,并分别在 A、B 两支试管中伸入带火星的木条,观察现象。 | A 试管中产生气泡,带火星的木条复燃,B 试管中无明显现象 |
Ⅱ.将“实验Ⅰ”中 A 试管的剩余物质分离,将所得固体进行洗涤、干燥、称量 | 所得固体质量为 a 克 |
Ⅲ.将“实验Ⅱ”得到的固体放入盛有 5 毫升 5%的过氧化氢溶液的试管中,向试管中伸入带火星的木条 | 有气泡冒出,带火星的木条复燃 |
Ⅳ.分别量取 5 毫升 5%的过氧化氢溶液放入 C、D 两 支试管中,向 C 试管中加入 a 克氧化铁粉末,向 D 试管中加入 a 克二氧化锰粉末 |
(实验结论)
(1)A 中产生的气体是_____;
(2)氧化铁可以作过氧化氢分解的催化剂,寻找该结论的证据主要是设计了实验_____(选填Ⅰ、Ⅱ、Ⅲ或Ⅳ)展开的。
(实验评价)
(1)设计实验Ⅲ的目的是_____;
(2)可以用下列方法作出判断,从而达到实验Ⅳ的设计目的。a.定性判断:观察 C、D两支试管中产生气泡的快慢;b.定量判断:_____。
(资料信息)过氧化氢分解除了用二氧化锰还可用氧化铜等物质作为催化剂
(提出问题 2)氧化铜(黑色粉末)是否也能作氯酸钾分解的催化剂?它是否比二氧化锰效果更好?
(实验设计 2)某同学以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2 克 | X | |
② | 1.2 克 | 氧化铜 0.5 克 | Y |
③ | m | 二氧化锰 0.5 克 | Z |
(1)写出氯酸钾在二氧化锰的催化作用下发生的反应的化学方程式:_____。
(2)上述实验应测量的“待测数据”是指_____,从数学描述角度,X、Y、Z 在数值上的大小关系是_____。
(3)若实验②比实验①的“待测数据”更_____(填“大”“小”或“不确定”),说明氧化铜能加快氯酸钾的分解速率。表中“m”的数值应该为_____。
(4)将实验②反应后的固体经过过滤、洗涤、干燥处理后,称量得到 0.5 克黑色粉末, 再将黑色粉末放入_____(简述操作)。
(总结提高)二氧化碳可用于灭火,但不是所有可燃物失火都可以用二氧化碳来扑灭。