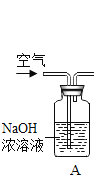
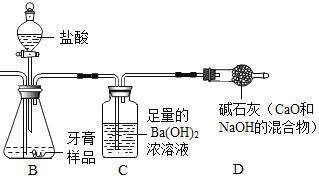
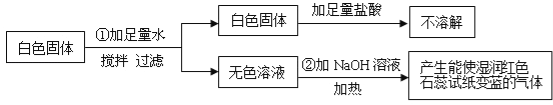
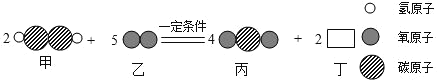
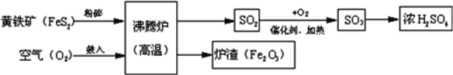题目内容
【题目】用工业废铁屑(含有油污)生产 NH4Fe(SO4)2·xH2O 的主要流程如下:
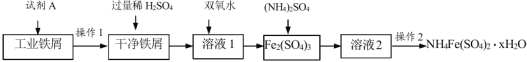
(1)加入试剂 A 的目的是除去油污。试剂 A 可以选择_______(选填序号)。
a Na2CO3 b 洗洁精 c 稀盐酸
(2)稀硫酸加入后应维持温度在 80℃~95℃之间,目的是_______。
(3)加入双氧水后反应方程式为_________。操作 2 包括:蒸发浓缩、_________、过滤、洗涤等。
【答案】b 使反应物充分接触并加快反应的速率,可以防止温度过高发生意外 2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O 冷却结晶
【解析】
(1)除去油污,可以利用洗洁精的乳化作用,故填:b。
(2)加热可以使反应物充分接触并加快反应的速率,但温度又不能太高,因为产物中有氢气产生,防止发生意外,因此稀硫酸加入后应维持温度在80℃~95℃之间;故填:使反应物充分接触并加快反应的速率,可以防止温度过高发生意外。
(3)加入双氧水后则硫酸亚铁会被氧化为硫酸铁,化学方程式为:2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O;大多数固体物质的溶解度随温度的降低而减小,因此要得到硫酸铁铵的晶体,可以采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,故填:2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O;冷却结晶。

【题目】以下是日常生活中常用的几种清洗剂,请回答:
洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 | 污渍爆炸盐 |
|
|
|
|
|
功能: 清除油污 | 有效成分: 盐酸 | 有效成分: 氢氧化钠 | 有效成分: 过氧化氢 | 有效成分: 过碳酸钠 |
(1)清除以下物质,可使用炉具清洁剂的是_____(填标号)。
a.铁锈 b.油污 c.水垢
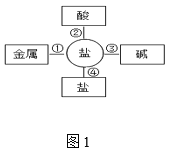
(2)污渍爆炸盐溶于水后生成Na2CO3和H2O2,再加入足量洁厕灵,产生能使澄清石灰水变浑浊的气体。产生该气体的反应体现了图1中_____(选填“①”、“②”、“③”或“④”)的性质关系。
(3)如图2甲所示,将洁厕灵滴入炉具清洁剂中。

①发生反应的化学方程式为_____,该反应属于_____(填基本反应类型)。
②若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_____,此时溶液可用图2乙中_____(选填“A”、“B”或“C”)点处表示。
③若反应后溶液pH为7,图2丙中a化学式为_____。
④下列试剂不能验证出反应后溶液处于图2乙中C点的是_____(填标号)。
a.pH试纸 b.铜粉 c.氧化铁 d.氢氧化铜 e.碳酸钙 f.硝酸银溶液