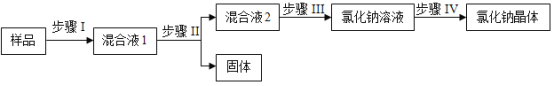
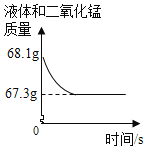
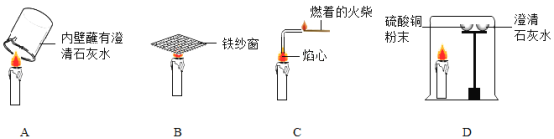
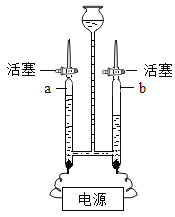
题目内容
【题目】某地每吨化肥的市场价格如下:尿素CO(NH2)21080元,硝酸铵NH4NO3810元。试回答下列问题:
(1)计算尿素的相对分子质量为________;
(2)计算硝酸铵中氮、氧元素质量比为________;(最简整数比)
(3)计算硝酸铵中氮元素质量分数为_____;
(4)用6480元购买的硝酸铵与多少钱购买的尿素中含氮量相等?写出计算过程____
【答案】60 7:12 35% 6480元
【解析】
(1)计算尿素的相对分子质量为:12+16+(14+1×2)×2=60,故填:60;
(2)计算硝酸铵中氮、氧元素质量比为(14×2):(16×3)=28:48=7:12,故填:7:12;
(3)计算硝酸铵中氮元素质量分数为![]() ×100%=35%,故填:35%;
×100%=35%,故填:35%;
(4)用6480元购买的硝酸铵中氮元素的质量为:![]() ×35%=2.8吨,
×35%=2.8吨,
则需要尿素的质量为:2.8吨÷![]() =6吨,需要付:6吨×1080元/吨=6480元。
=6吨,需要付:6吨×1080元/吨=6480元。

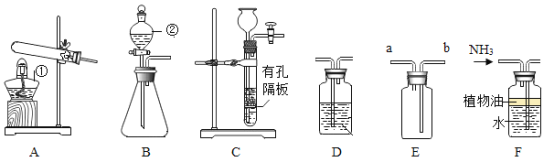
【题目】化学通过实验研究物质的组成、性质和变化规律的学科。
甲 | 乙 | 丙 | 丁 |
|
|
|
|
电解水 | 验证水的元素组成 | 铁丝燃烧 | 测定空气中氧气体积分数 |
(1)实验甲中电解一定量的水产生了x摩尔氢气。
质量(克) | 体积(升) | 物质的量(摩尔) | |
氢气 | x |
①上表中有些空格不能填写(请不必填写),是因缺少什么条件?_____;
②电解水的化学方程式是____;生成的正极气体和负极气体质量比是______。
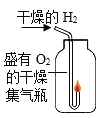
(2)实验乙中,观察到集气瓶内壁有___产生,可以得出结论:水由___两种元素组成。
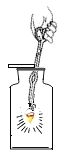
(3)实验丙中铁丝在氧气中燃烧的化学方程式是____,该实验中一个明显错误是___。
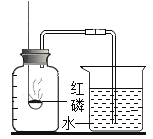
(4)实验丁中红磷燃烧的化学方程式是____。根据此实验装置图,红磷燃烧的过程中烧杯内会产生的现象是:____。若其他操作均正确,该同学得到的氧气的体积分数将___(选填“偏大”、“偏小”或“无影响”)。