题目内容
【题目】化学通过实验研究物质的组成、性质和变化规律的学科。
甲 | 乙 | 丙 | 丁 |
|
|
|
|
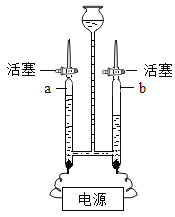
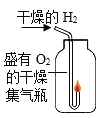
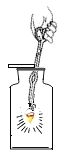
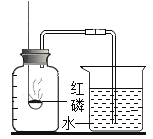
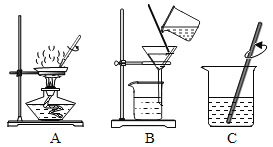
电解水 | 验证水的元素组成 | 铁丝燃烧 | 测定空气中氧气体积分数 |
(1)实验甲中电解一定量的水产生了x摩尔氢气。
质量(克) | 体积(升) | 物质的量(摩尔) | |
氢气 | x |
①上表中有些空格不能填写(请不必填写),是因缺少什么条件?_____;
②电解水的化学方程式是____;生成的正极气体和负极气体质量比是______。
(2)实验乙中,观察到集气瓶内壁有___产生,可以得出结论:水由___两种元素组成。
(3)实验丙中铁丝在氧气中燃烧的化学方程式是____,该实验中一个明显错误是___。
(4)实验丁中红磷燃烧的化学方程式是____。根据此实验装置图,红磷燃烧的过程中烧杯内会产生的现象是:____。若其他操作均正确,该同学得到的氧气的体积分数将___(选填“偏大”、“偏小”或“无影响”)。
【答案】密度 2H2O![]() 2H2↑+O2↑ 8∶1 水珠 氢、氧 3Fe+2O2
2H2↑+O2↑ 8∶1 水珠 氢、氧 3Fe+2O2![]() Fe3O4 集气瓶底部未铺一层细沙或放少量水 4P+5O2
Fe3O4 集气瓶底部未铺一层细沙或放少量水 4P+5O2![]() 2P2O5 导管口现有气泡产生,一段时间后烧杯中水被倒吸进入集气瓶中 偏大
2P2O5 导管口现有气泡产生,一段时间后烧杯中水被倒吸进入集气瓶中 偏大
【解析】
(1)①已知氢气的物质的量,可求氢气的质量,但是不知道氢气的密度无法求氢气的体积,故填:密度;
②电解水的方程式为:2H2O![]() 2H2↑+O2↑,故填:2H2O
2H2↑+O2↑,故填:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
生成氢气和氧气的质量比为2×2:32=1:8;
(2)实验乙中,观察到集气瓶内壁有水珠产生,故填:水珠;
氢气由氢元素组成,氧气由氧元素组成,水由氢、氧两种元素组成。
(3)铁丝在氧气中燃烧的化学方程式为:3Fe+2O2![]() Fe3O4,故填:3Fe+2O2
Fe3O4,故填:3Fe+2O2![]() Fe3O4;
Fe3O4;
铁丝燃烧生成的高温熔融物落下容易导致集气瓶炸裂,故应在集气瓶底部未铺一层细沙或放少量水,故填:集气瓶底部未铺一层细沙或放少量水;
(4)红磷燃烧的化学方程式为:4P+5O2![]() 2P2O5,故填:4P+5O2
2P2O5,故填:4P+5O2![]() 2P2O5;
2P2O5;
红磷燃烧放热使集气瓶内气体体积膨胀,使一定气体通过导管进入烧杯中,使集气瓶内气体减少,测得氧气体积分数偏大;红磷燃烧消耗氧气,一段时间后,烧杯中的水会被倒吸入集气瓶中,故填:导管口现有气泡产生,一段时间后烧杯中水被倒吸进入集气瓶中,偏大;

【题目】氯化钠与硝酸钠的溶解度曲线如图:
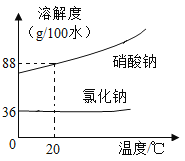
(1)20℃时溶解度较小的物质是______。
(2)从硝酸钠和氯化钠的混合溶液中提纯硝酸钠的方法是_____,可以利用该方法提纯硝酸钠的理由是_____。
Ⅰ.固体混合物中硝酸钠的含量较高,氯化钠的含量较低
Ⅱ.硝酸钠的溶解度受温度影响变化较大
Ⅲ.0℃至100℃,硝酸钠的溶解度始终大于氯化钠
(3)海水中有氯化钠,我们可以利用海水晒盐。某地海水中主要物质的含量见表。
物质 | 每100g海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… |
①该海水中氯化钠的质量分数为_____。
②20℃时的100g该海水,当水的蒸发量大于____g时,开始析出氯化钠。
【题目】将丙醇(![]() )和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。下列判断正确的是( )
)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。下列判断正确的是( )
物质 |
|
|
|
| X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | A |
A.X是该反应的催化剂B.X是该反应的反应物
C.X可能含有氧元素D.X不可能含有氢元素