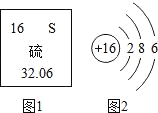
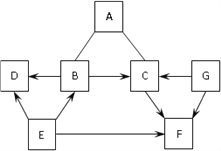
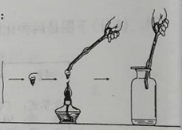
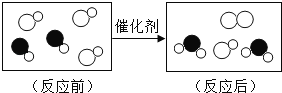
题目内容
【题目】某氯化钠样品中含有硫酸钠、氯化镁、氯化钙等杂质,设计如下过程除去杂质:
步骤Ⅰ:加足量的水溶解。
步骤Ⅱ:依次加入过量的氯化钡溶液、过量的氢氧化钠溶液、过量的X溶液,充分反应后过滤。
步骤Ⅲ:加入足量的稀盐酸。
根据上述过程回答下列问题:
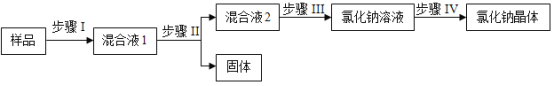
(1)步骤Ⅰ需要用到的玻璃仪器是_____和______。
(2)(2)步骤Ⅱ中加入氢氧化钠溶液时,发生反应的化学方程式是_________________;物质X是_____溶液。
(3)步骤Ⅱ得到的固体中主要含有的物质是___________。步骤Ⅱ中可以用过量的____溶液(填一种物质)代替氯化钡和氢氧化钠两种溶液,一举两得,也可以达到相同实验目的。
(4)步骤Ⅲ加入足量稀盐酸,目的是___________;步骤Ⅳ的实验操作名称是_______。
【答案】烧杯 玻璃棒 Na2SO4+BaCl2=BaSO4↓+2NaCl 碳酸钠溶液 硫酸钡、氢氧化镁、碳酸钙、碳酸钡 氢氧化钡溶液 除去过量的氢氧化钠和碳酸钠 蒸发
【解析】
(1)由实验的过程可知,在加足量的水溶解氯化钠样品时,要用到烧杯和玻璃棒;
(2)步骤Ⅱ中加入氢氧化钠溶液时,能将氯化镁除去,发生反应的化学方程式是:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;通过上述试验,溶液中有氯化钙、过量的氯化钡,应加入过量的碳酸钠溶液除去。
(3)由于硫酸钠与氯化钡反应生成了硫酸钡沉淀,氢氧化钠与氯化镁反应生成了氢氧化镁沉淀,碳酸钠与氯化钡、氯化钙反应生成了碳酸钙沉淀和碳酸钡沉淀。所以,步骤Ⅱ得到的固体中主要含有的物质是硫酸钡、氢氧化镁、碳酸钙、碳酸钡。由于氢氧化钡既能与硫酸钠反应又能与氯化镁反应,步骤Ⅱ中可以用过量的氢氧化钡溶液代替氯化钡和氢氧化钠两种溶液,也可以达到相同实验目的;
(4)由于溶液中能够还含有过量的氢氧化钠和碳酸钠,步骤Ⅲ加入足量稀盐酸的目的是:除去过量的氢氧化钠和碳酸钠;步骤Ⅳ中将食盐水进行蒸发结晶得到精盐。
故答为:(1)烧杯和玻璃棒;(2)MgCl2+2NaOH═Mg(OH)2↓+2NaCl;碳酸钠;(3)硫酸钡、氢氧化镁、碳酸钙、碳酸钡;氢氧化钡;(4)除去过量的氢氧化钠和碳酸钠;蒸发结晶。

 每课必练系列答案
每课必练系列答案【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入12.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
请回答:
(1)12g样品中生成沉淀________g。
(2)样品中碳酸钠的质量分数是________?(写出计算过程,结果精确到0.1%)
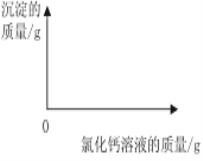
(3)在如图中绘制出白色沉淀与加入氯化钙溶液的质量关系图___________(图上要注明白色沉淀、氯化钙溶液的相关质量)。