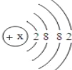
��Ŀ����
����Ŀ��ijУ��ѧ��ȤС�齫��ʣ�Ĺ���������Һ����������������ķ�Һ���У����ֲ����˴��������ݣ������������Ϊ����������ѧ����֪ʶ�����жϣ������������е�ij�����ʼӿ��˹�������ķֽ⣬��ô�������������ʼӿ��˹�������ķֽ����ʣ�����������ǵ��о�������������̽��ʵ��Ŀ��֡�
����������裩
��ͬѧ������������������ӿ���H2O2����Һ�ֽ⡣
��ͬѧ���������__________�ӿ���H2O2����Һ�ֽ⡣
����Ʒ�����ʵ�飩������б���
ʵ�鷽�� | ʵ������ | ���� |
����һ����ʢ��10mL 5% H2O2��Һ���Թ��м���2g��������ĩ����һ�������ǵ�ľ�������Թܿڣ��۲����� | ________ _________ | ��ͬѧ���۳����� |
����������ʢ��10mL 5% H2O2��Һ���Թ��м���_____��ĩ����һ�������ǵ�ľ�������Թܿڣ��۲����� | ������ | ��ͬѧ����_____�� (���������������) |
�����۽�������ͬѧ��Ϊ������һ��ֻ��˵��Fe2O3�ӿ���H2O2��Һ�ķֽ⣬������˵Fe2O3��һ���Ǵ��������Ƿ�֧�ֱ�ͬѧ�Ĺ۵㣿_____�����Ҫ֤���������Ǵ�������Ҫ���һ��ʵ����֤�������ʵ������ԭ����______��
����չ��
(1)ʵ��֤��Fe2O3��ĩ������ΪH2O2�ֽ�Ĵ������÷�Ӧ�Ļ�ѧ����ʽ__________
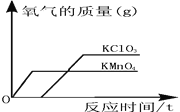
(2)�±��DZ�ͬѧ̽��Ӱ��H2O2�ֽ�����ʱ����¼�IJ������ݣ�ͨ�������ݷ��������ܵó�ʲô���ۣ�________________��
�����������H2O2��Һ��ȡ��ͬ���O2�����ʱ�䣺
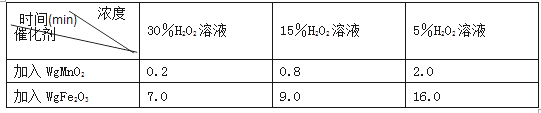
���𰸡��� ������������ ������ľ����ȼ �� ������ ֧�� ��֤Fe2O3�ڷ�Ӧǰ�������ͻ�ѧ���ʶ�û�иı� 2H2O2![]() 2H2O+O2�� ��ͬ�����£��������̱��������Ĵ�Ч���ã��ҹ���������ҺŨ��Խ��ӦԽ��
2H2O+O2�� ��ͬ�����£��������̱��������Ĵ�Ч���ã��ҹ���������ҺŨ��Խ��ӦԽ��
��������
�����������
���������������Ҫ�ǣ���������������ͬѧ���룺����������������ӿ���H2O2����Һ�ֽ⣬ʵ����ͬѧ������������ӿ���H2O2����Һ�ֽ⣻
��Ʒ�����ʵ����
����һ������ͬѧ���۳���������������������ӿ���H2O2����Һ�ֽ�������ʵ������Ϊ�д������ݲ�����������ľ����ȼ��
��������������ͬѧ�IJ����֪��Ӧ��ʢ��10mL5% H2O2��Һ���Թ��м������ۣ�û������˵����ͬѧ���۲�������
���۽�����
����һֻ��˵��Fe2O3�ӿ���H2O2��Һ�ķֽ⣬������˵Fe2O3��һ���Ǵ�������Ϊ�������˸ı䷴Ӧ������֮�⣬���Ļ�ѧ���ʺ������ڷ�Ӧǰ����벻�䣬����֧�ֱ�ͬѧ�Ĺ۵㣻���Ҫ֤���������Ǵ���������Ҫ���ʵ����֤Fe2O3�ڷ�Ӧǰ�������ͻ�ѧ���ʶ�û�в��䣻
��չ��
��1�������������������Ĵ�����������ˮ����������Ӧ�Ļ�ѧ����ʽΪ��2H2O2![]() 2H2O+O2����
2H2O+O2����
��2��ͨ���Ա������ݷ�����֪���������ͬ������������ͬ�����Եó��Ľ����ǣ���ͬ�����£��������̱��������Ĵ�Ч���ã��ҹ���������ҺŨ��Խ��ӦԽ�졣

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�