题目内容
【题目】试依据核电荷数为1﹣18的元素的原子结构示意图回答下列问题:
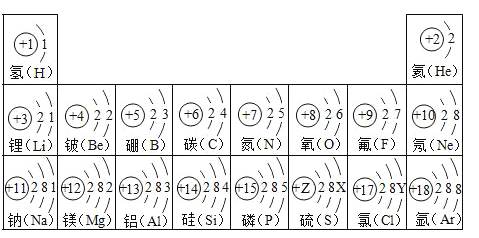
(1)氯元素的最外层电子数Y=______(填数值),它与钠元素组成的物质是由______构成(填“分子”、“分子”或“离子”).
(2)硫元素的核电荷数Z=_____,该元素的原子核外有____个电子层,其化学性质比较活泼,在化学反应中易_____(填“得”、“失”)电子,形成阴离子,离子的符号是_____.
(3)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图所示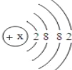 ,则该元素的原子序数为______,它的原子与______元素的原子化学性质相似.
,则该元素的原子序数为______,它的原子与______元素的原子化学性质相似.
【答案】7 离子 16 3 得 S2﹣ 20 镁、铍
【解析】
(1)原子中,质子数=核电荷数=原子序数=核外电子数,17=2+8+Y , Y=7;它与钠元素组成的物质是由氯化钠是由离子构成的;
(2)根据元素周期律:在元素周期表中,同一周期元素从左到右原子序数的逐渐递增,硫元素的核电荷数介于15与17 之间,所以硫元素的核电荷数z=16;该元素的原子核外有3个电子层,其化学性质比较活泼,在化学反应中易得到电子2个电子,形成带2个单位负电荷的阴离子,形成的离子的符号为: S2-;
(3)原子中,质子数=核电荷数=原子序数=核外电子数,钙的质子数=2+8+8+2=20;元素的化学性质与最外层电子数的关系密切,钙原子的最外层电子数为2,镁原子的最外层电子数为2,钙的原子与镁元素、铍元素的原子化学性质相似。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】铁的活动性比铜强。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_________; 猜想三:Fe>Cu>R
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | ____________ | 猜想一正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率_________(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在空气中____________ |
写出铁丝在氧气中燃烧的化学方程式____________________。
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)盒属与_________是否反应。
【题目】某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气。根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐。
(猜想与假设)
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解。
乙同学:铁钉里的__________加快了H2O2的溶液分解。
(设计方案和实验)完成下列表格
实验方案 | 实验现象 | 结论 |
方案一:向盛有10mL 5% H2O2溶液的试管中加入2g氧化铁粉末,将一根带火星的木条放在试管口,观察现象。 | ________ _________ | 甲同学结论成立。 |
方案二:向盛有10mL 5% H2O2溶液的试管中加入_____粉末,将一根带火星的木条放在试管口,观察现象。 | 无现象 | 乙同学结论_____。 (填“成立”或“不成立”) |
(讨论交流)丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂。你是否支持丙同学的观点?_____,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是______。
(拓展)
(1)实验证明Fe2O3粉末可以作为H2O2分解的催化剂。该反应的化学方程式__________
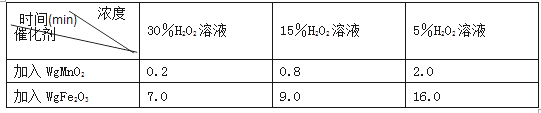
(2)下表是丙同学探究影响H2O2分解速率时所记录的部分数据,通过对数据分析,你能得出什么结论?________________。
用足量等体积H2O2溶液制取相同体积O2所需的时间:
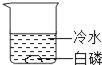
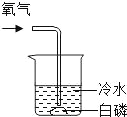
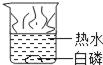
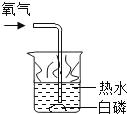
【题目】通常情况下,燃烧需要三个条件,如图所示的实验中,能证明可燃物燃烧与温度有关的是( )
实验① | 实验② | 实验③ | 实验④ |
|
|
|
|
白磷不燃烧 | 白磷不燃烧 | 白磷不燃烧 | 白磷燃烧 |
A. ②④ B. ②③ C. ①③ D. ①④